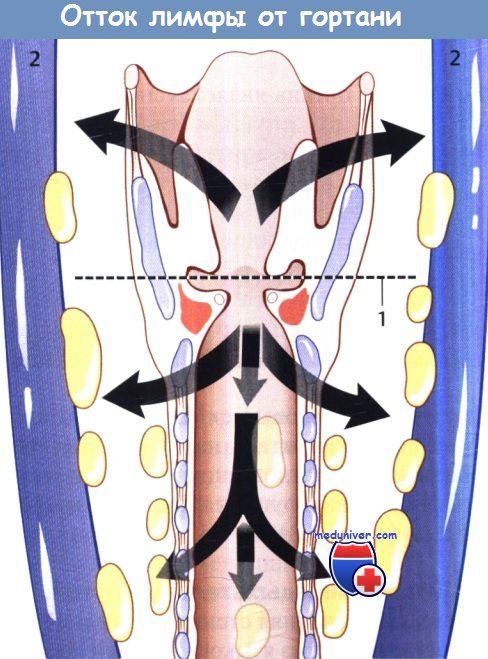
Пластика при раке гортани
Несмотря на усовершенствование техники ушивания дефектов глотки, применение новейших медикаментозных средств, направленных на предупреждение развития воспалительных процессов в ране, послеоперационный период часто осложняется расхождением раны с образованием обширных дефектов стенок глотки и шейного отдела пищевода (Пачес А. И., 1971; Цыбырнэ Г. А., 1972; Огольцова Е. С, 1977). Эти осложнения нередко встречаются после задних расширенных и комбинированных ларингэктомий, т. е. когда из-за распространенности процесса резецируют шейный отдел пищевода и гортанную часть глотки. Порой такие расширенные хирургические вмешательства заканчиваются созданием плановых фарингоэзофагостом.
Необходимо отметить, что дефекты глотки и пищевода после расширенных ларингэктомий наблюдаются чаще у больных, получивших до операции лучевую терапию в полной лечебной дозе 55 Гр (Пачес А. И. и соавт., 1976).
Наличие дефектов глотки и пищевода вынуждает больных длительное время питаться через носопищеводный зонд. Последний вызывает тягостное ощущение, гиперсаливацию, учащение глотания, рвоту.
Длительное применение зонда приводит к возникновению пролежней, образованию рубцов у краев фарингостомы, что значительно усложняет проведение последующих пластических операций. Все эти неудобства резко угнетают больных, они становятся замкнутыми, подавленными и раздражительными, а их общее состояние ухудшается.
Быстрейшее избавление от дефектов глотки и пищевода является одной из главных и актуальных проблем медицинской реабилитации больных, перенесших расширенные и комбинированные операции на гортани. Опыт показывает, что в обеспечении успеха пластических и восстановительных операций важную роль играют несколько существенных моментов.
1. Изучение иммунобиологического статуса организма перед пластической операцией. Длительное питание через носопищеводный зонд, выраженные трофические изменения в тканях, наступившие в результате применения массивных доз облучения, отрицательно влияют на состояние иммунобиологической реактивности организма. В связи с этим мы изучили некоторые показатели неспецифического иммунитета у 32 больных, у которых предполагалось пластическое замещение дефектов глотки. Установлено, что у больных этой группы по сравнению со здоровыми резко нарушено функциональное состояние иммунокомпетентных клеток, в то время как количественный состав лейкоцитов в периферической крови, являющихся морфологическим субстратом их образования, оставался без существенных изменений.
Так, количество розеткообразующих клеток в 1 мм3 крови у больных снижалось до 33,9±7,2, у здоровых было 37,0±34,7 (Р<0,001). Содержание аутоантителообразующих клеток падало с 2,4±0,3 до 0,5±0,06 (Р<0,001). Степень нарушения иммунного статуса организма зависела от распространенности опухолевого процесса, объема оперативного вмешательства и дозы принятого до операции облучения. Для повышения имму-нореактивности организма больным в течение трех дней до операции ежедневно переливали по 200 мл одногруппной свежецитратной крови.
2. Сроки оперативных вмешательств в зависимости от примененных доз облучения. На основании своих исследований Ф. М. Хитров (1963) и К. А. Молчанова (1970) пришли к выводу, что наиболее оптимальными сроками проведения пластических операций с целью восстановления дефектов глотки и пищевода в зависимости от примененных доз облучения являются 6-12 мес.
Наш клинический опыт показывает что если больной до операции не подвергался лучевой терапии или получил предоперационный курс дистанционной гамма-терапии в плане комбинированного метода в дозе 45 Гр, то оптимальный срок пластики — 2—4 мес. После полного курса лучевого лечения в дозе 65-70 Гр наиболее благоприятным сроком пластики считаем 6-8 мес. При операциях в эти сроки мы наблюдали наименьшее число осложнений.
– Читать далее “Методика пластики дефектов глотки. Пример пластики фарингостомы”
Оглавление темы “Ребилитация после операции при раке гортани”:
1. Пример комбинированного лечения рака гортани. Осложнения комбинированной терапии рака гортани
2. Осложнения терапии рака гортани. Реабилитация пациентов в онкологии
3. Реабилитация больных раком слизистой носа. Пластика слизистой носа
4. Пластика полости рта шейным лоскутом. Пластика дельто-пекторальным лоскутом дна полости рта
5. Реабилитация после операции по поводу рака гортани. Пластика дефекта гортани
6. Методика пластики дефектов глотки. Пример пластики фарингостомы
7. Пластика фарингоэзофагостом. Дельто-пекторальный лоскут при фарингостомах
8. Пример пластики фарингоэзофагостомы. Техника пластики глотки дельто-пекторальным лоскутом
9. Эффективность закрытия фарингостомы. Этапная пластика фарингоэзофагостомы
10. Шейно-плечевой лоскут для закрытия фарингостомы. Плечевой лоскут для пластики фарингоэзофагостомы
Источник
Клинические признаки
Рак гортани III стадии характеризуется распространенностью опухоли с поражением 1-3 ее анатомических отделов, без выхода за пределы органа, а также с/без поражением одного л/узла шеи (с его увеличением не более 3см). Исходя из вышеизложенного, основным признаком рака гортани третьей стадии является паралич одной или обеих голосовых складок, что может сопровождаться осиплостью или потерей голоса , а при двухстороннем поражении голосовые складки могут полностью перекрывать просвет гортани, не позволяя пациенту адекватно дышать (вплоть до асфиксии, из-за чего еще до начала лечения может выполняться трахеостомия).
При поражении же лимфатического узла шеи пациент может сам заметить появление «припухлости» на шее, которое более ничем не беспокоит (узел , как правило, безболезненный).
Дополнительными специфическими симптомами, на которые пациент может обратить внимание врача, могут быть:
- ощущение комка в горле при глотании,
- поперхивание, кашель ( в мокроте могут определяться прожилки крови)
- боль в горле в покое и при глотании
- неприятный (гнилостный) запах изо рта
Общими симптомами для многих онкологических заболеваний и , в частности, для рака гортани являются:
- повышенная до субфебрильных и фебрильных (при присоединении бактериальной инфекции) значений температура тела
- постоянное недомогание;
- анемия
- снижение массы тела
- быстрая утомляемость
- апатия, сонливость
Диагностика рака на III стадии
Для проведения диагностики рака на третьей стадии врач тщательно собирает анамнез болезни со слов больного, ориентируясь в первую очередь на его жалобы.
Далее, исходя из данных анамнеза и физикального осмотра (внешний осмотр и пальпация), назначается план обследования. Основными пунктами этого плана являются следующие методы обследования:
- Непрямая и Прямая ларингоскопия (фиброларингоскопия). Последняя позволяет произвести осмотр всех отделов гортани с максимальной четкостью. Введение инструмента в гортань не причиняет какого-либо вреда больному, позволяя выполнить высококачественную фото и видеосьёмку.
- Во время фиброларингоскопии выполняется биопсия опухоли и полученные образцы тканей отправляются на гистологическое (включая иммуногистохимическое) и цитологическое исследования для постановки морфологического диагноза (чтобы понять какого строения опухоль, степень ее дифференцировки)
- УЗИ шеи и органов брюшной полости ( для исключения или определения метастазов, их локализации и размеров)
- Рентгенография органов грудной клетки ( для исключения метастазов в легких)
Современная медицина дает возможность не только диагностировать заболевание, но и выявить его особенности.
Если полученных данных врачу недостаточно для постановки диагноза или определения операбельности, то прибегают к назначению уточняющих или дополнительных методов диагностики:
- компьютерная томография (КТ) шеи, органов грудной клетки
- магнитно-резонансная томография (МРТ) шеи, органов грудной клетки, органов брюшной полости)
- Радиоизотопное исследование костей скелета
- определение связи опухоли с наличием HPV (ВПЧ) – инфекции (ВПЧ – Вирус Папилломы Человека)
- молекулярно-генетическая диагностика опухолевой ткани ( при планировании таргетной или иммунной терапии)
Вышеперечисленные диагностические методы необходимы для правильной постановки диагноза и назначения соответствующего лечения.
Лечение рака на III стадии
Среди всех больных раком гортани, обращающихся за помощью в медицинские учреждения, пациенты с III стадией составляют самую многочисленную и разнообразную по распространенности группу. В связи с чем эти пациенты являются самыми сложными в диагностике и выборе тактики лечения. Именно поэтому для борьбы с раком на третьей стадии чаще всего применяется комплексная терапия (сочетание хирургического, лучевого и лекарственного лечения). Только своевременное начало и правильное сочетание всех вышеуказанных видов лечения, как правило, позволяет добиться максимального эффекта, т.е. излечения от данного заболевания.
Хирургическое лечение
Наиболее радикальным видом лечения рака гортани продолжает оставаться хирургическое (ларингэктомия/резекция гортани + шейная лимфодиссекция). Но больше всего данное положение относится к складочной локализации опухолевого процесса и при четких границах первичной опухоли. Далее, при условии радикально выполненной операции, эффект может быть закреплен лучевой терапией. Существующие в настоящее время голосовые протезы, устанавливаемые одномоментно с удалением гортани, позволяют в максимально короткие сроки (от 2-х недель спустя от дня операции) вернуться пациенту к достойному качеству жизни без потери голоса.
Химиотерапия
При инфильтративных опухолях и распространении на надскладочный отдел наиболее эффективным признано начало лечения с химиотерапии (неоадъювантная) или сочетанного химиолучевого лечения. Стандартной схемой первой линии является TPF (таксаны, препараты платины, 5-фторурацил). Проведение одного курса занимает 4-5 дней в условиях стационара. Цикл 21 день (это означает , что от первого дня первого курса химиотерапии до первого дня второго курса должно пройти 3 недели). После 2-3 курсов назначается контрольное обследование, оценивается эффект и консилиумом определяется дальнейшая тактика. При сочетанном химиолучевом лечении во время лучевой терапии еженедельно вводятся препараты платины. Схема полихимиотерапии, дозировки препаратов и режимы введения определяются химиотерапевтом индивидуально для каждого больного, исходя из его общего состояния, показателей обследования, а также из вида и распространенности опухоли.
В ряде случаев, при условии высокой чувствительности опухоли (это выясняется в процессе лечения), излечение может наступить и без выполнения операции.
Лучевая терапия
Лучевая терапия, как и химиотерапия, в моноварианте не применяется при раке гортани III стадии. В сочетании с химиотерапией, при условии высокой чувствительности опухоли, применяется в виде радикального курса (с доведением суммарной очаговой дозы до 65-70 Гр). Лечение проводится в режиме 5 дней в неделю по РОД 2Гр/день, соответственно длится около семи рабочих недель. Режим послеоперационной лучевой терапии радиолог определяет индивидуально, исходя из факторов прогноза (определяются по данным гистологического исследования операционного материала).
Диета
Питание больного раком гортани должно препятствовать усугублению изначальных симптомов заболевания и побочных эффектов лечения, а также истощению организма. Пищу необходимо хорошо термически и механически обрабатывать, дабы она не травмировала глотку и быстро усваивалась. Температура продуктов перед употреблением должна быть близка к комнатной. Употребляемые продукты тщательно измельчаются и принимаются небольшими порциями 5-6 раз в сутки. Объем потребляемой воды не менее 2-х литров.
- слизистые протертые супы, сваренные на нежирном мясном бульоне;
- полувязкие крупяные каши, сваренные на воде пополам с молоком;
- отварные блюда из рыбы, измельченные с помощью блендера;
- овощные пюре из картофеля, моркови, тыквы, свеклы и капусты;
- фруктовые, овощные свежевыжатые соки ( исключить кислые)
- кисломолочные продукты, включая йогурты, кефир и ряженку.
Обязательно следует учесть, что пища не должна быть жареной, острой, содержать специи и приправы. Также следует отказаться от кофе, крепкого чая и алкогольных напитков.
Прогноз
Если диагноз был поставлен правильно, а лечение начато своевременно, то пятилетняя выживаемость пациентов, у которых диагностирован рак гортани на третьей стадии, составляет около 50-80%. Пациенту нужно помнить , что это зависит не только от множества вышеперечисленных факторов, включая опыт и уровень профессионализма врача, технического и медикаментозного обеспечения клиники, но и от собственного желания пациента вылечиться. Тщательное следование рекомендациям врача до, во время и после лечения не менее важны в достижении позитивного результата в борьбе с заболеванием.
Источник
Методы открытых операций при раке гортаниИспользование открытых хирургических доступов в лечении злокачественных новообразований надсвязочного и связочного отделов гортани проверено долгими годами практики, с их помощью возможно добиваться отличных онкологических результатов. Среди открытых методов удаления новообразований выделяют, в порядке возрастания сложности: ларингофиссура с хордэкто-мией и последующей реконструкцией, вертикальная частичная ларингэктомия, надскдалочная горизонтальная ларингэктомия, надперстневидная ларингэктомия, тотальная ларингэктомия. Все варианты вмешательств, при которых гортань не удаляется полностью, называют органосохраняющими. Хордэктомия с последующей реконструкцией проводится пациентам с опухолью Т1, которым по каким-то причинам невозможно выполнение эндоскопической операции. У некоторых пациентов (например, с ретрогнатией, тризмом, лучевой терапией в анамнезе) визуализация передней комиссуры затруднена, поэтому удалить опухоль эндоскопически невозможно. Хордкэтомия с реконструкцией не рекомендуются пациентам, у которых опухоль прорастает на противоположную голосовую складку. Чаще всего необходима трахеотомия. При простой хордкэтомии приемлемым вариантом реконструкции является простое заживление вторичным натяжением, впоследствии, если это требуется, выполняется аугментационная медиализация. Также описаны методы интраоперационной реконструкции, когда новая голосовая складка формируется из подподъязычных мышц. В большинстве случаев у пациентов, которым была проведена хордэктомия с ларингофиссурой, функции речи и глотания сохраняются, хотя чаще всего голос становится слабым.
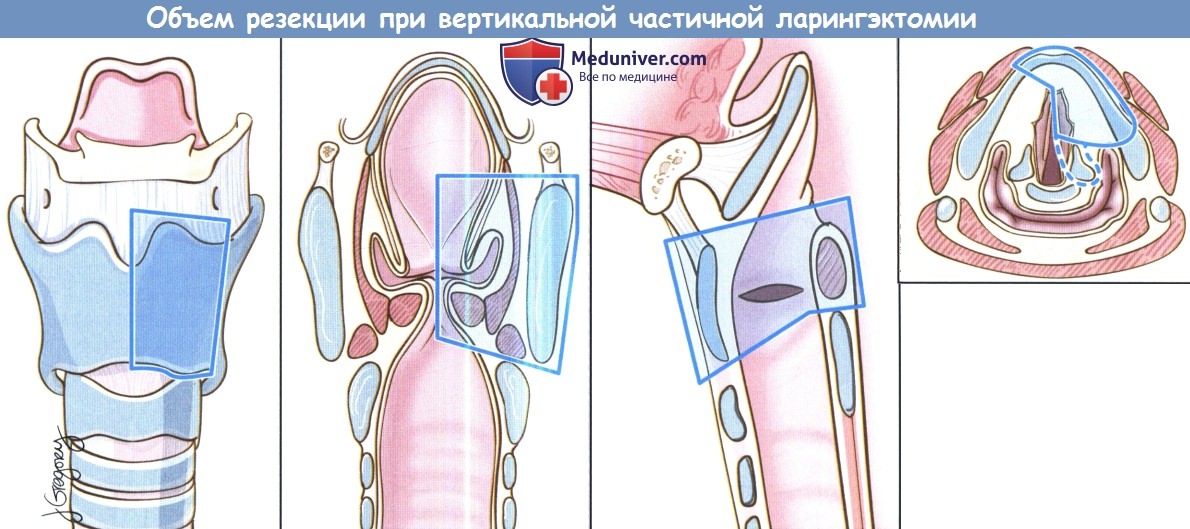
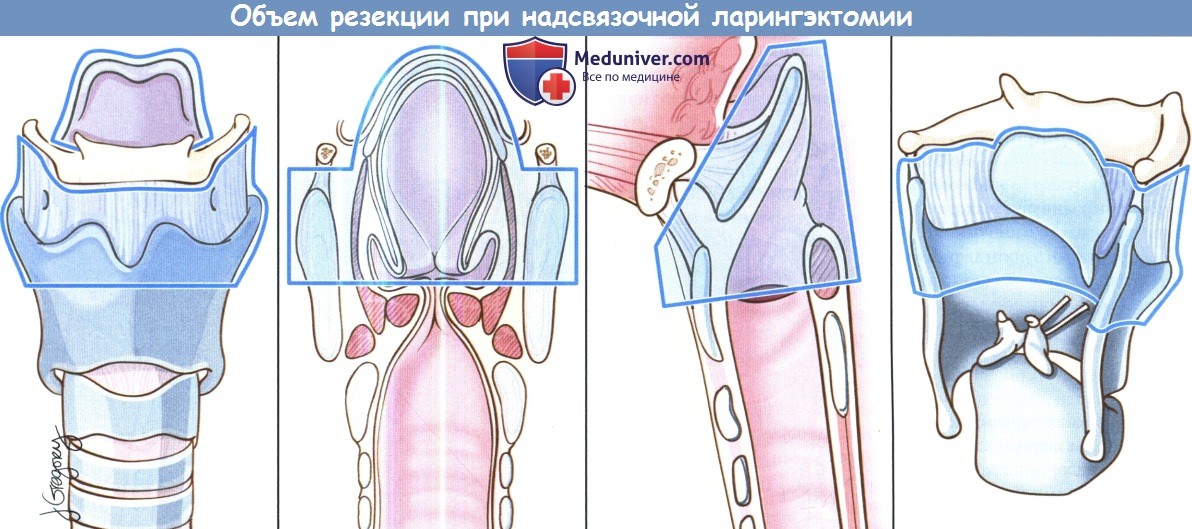
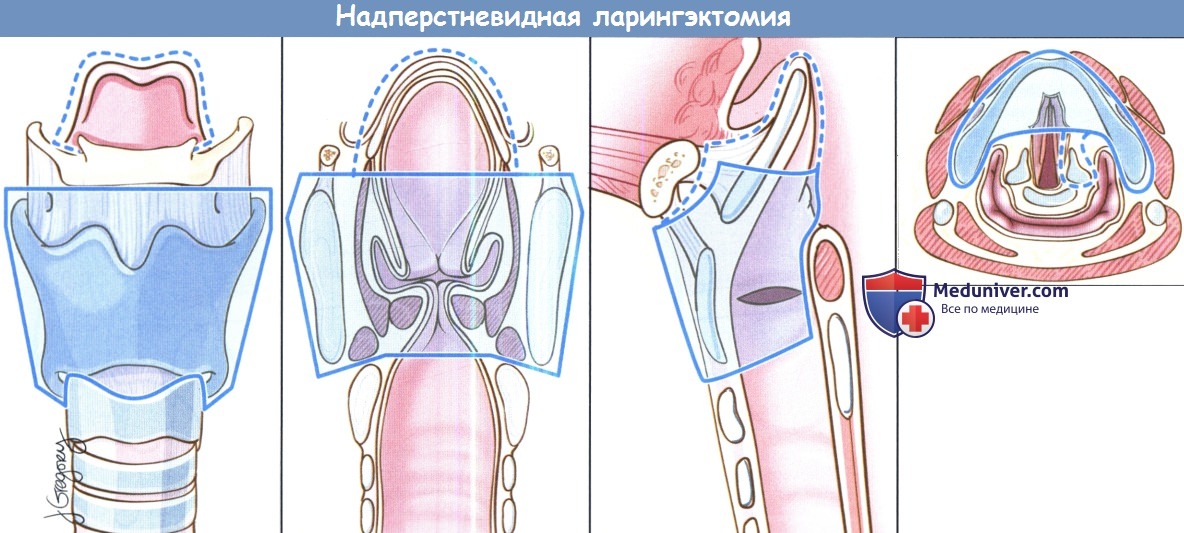
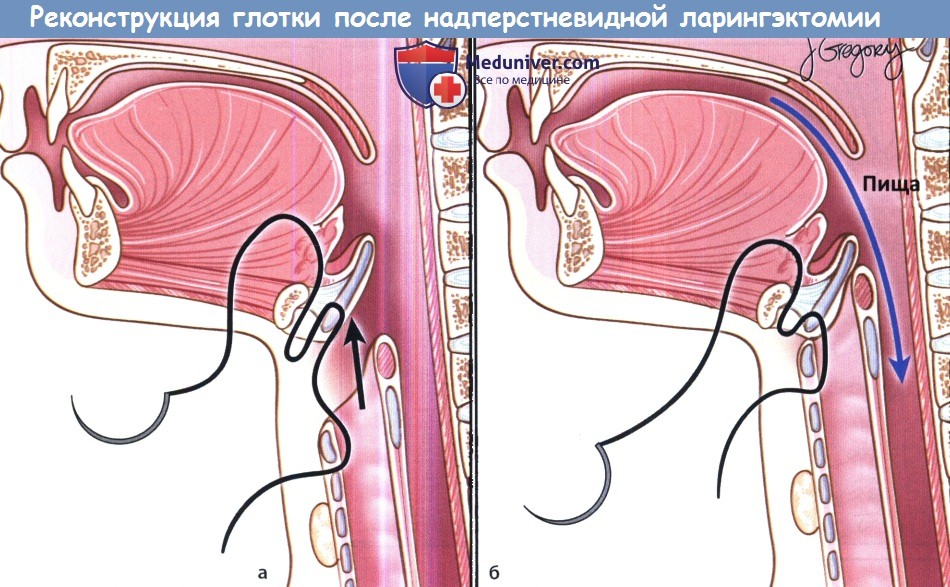
Вертикальная частичная ларингэктомия выполняется при опухолях Т1 и некоторых Т2. Чаще всего требуется трахеотомия. К противопоказаниям относится наличие опухоли Т3 без фиксации перстнечерпаловидного сустава, т.к. в данном случае предпочтительнее надперстневидная ларингэктомия. Выполняется ларингофиссура, локализация разреза для тиреотомии зависит от расположения опухоли, предварительно оцениваемого при помощи эндоскопии. При стандартной вертикальной частичной ларингэктомии голосовая складка удаляется от передней комиссуры до голосового отростка черпаловидного хряща сзади, вместе с внутренними мышцами гортани. Было описано множество «расширений» доступа, в том числе фронтолатеральная вертикальная гемиларингэктомия, заднелатеральная вертикальная гемиларингэктомия, расширенная вертикальная гемиларингэктомия. Как и при простой хордэктомии, описано множество вариантов реконструкции с целью восстановления голосовой функции. Открытая надскладочная ларингэктомия выполняется при опухолях Т1 и Т2, локализующихся в надсвязочном отделе гортани. Успешность лечения при опухолях Т1 составляет более 90%. Противопоказания включают распространение опухоли до уровня голосовой щели, инвазию в перстневидный или щитовидный хрящи, инвазию в корень языка более, чем на 1 см от желобовидных сосочков, поражение глубоких мышц языка или преднагортанникового пространства. При стандартной надскладочной ларингэктомии сохраняются обе голосовые складки, оба черпаловидных хряща, корень языка и подъязычная кость. При инвазии опухоли в преднагортанниковое пространство необходимо удаление подъязычной кости, которую в противном случае можно оставить нетронутой. При резекции щитовидной кости особенно важно сохранить верхний гортанный сосудисто-нервный пучок (также об этом необходимо помнить при надперстневидной ларингэктомии). Методы реконструкции те же, что и при надперстневидной ларингэктомии. Самый широкий спектр возможностей обеспечивает надперстневидная ларингэктомия, поскольку она может использоваться при опухолях Т1,Т2,Т3 и некоторых Т4 стадий, как при надскладочной, так складочной локализации. Выполнение надперстневидной ларингэктомии возможно и при снижении подвижности или фиксации голосовых складок, поражении гортанных желудочков или передней комиссуры, ограниченной эрозии щитовидного хряща без экстраларингеального распространения. В большинстве крупных исследований удавалось добиться высоких уровней пятилетней выживаемости и подавления местно-регионарного опухолевого роста. Противопоказаниями к надперстне-видной ларингэктомии являются фиксация перстнечерпаловидного сустава, поражение наружных мышц гортани, поражение возвратного гортанного нерва, распространение в подскладочное пространство более чем на 1 см, инвазия в перстневидный хрящ, заднюю комиссуру, экстраларингеальный рост, поражение надхрящницы наружной поверхности щитовидного хряща. Все ткани удаляются единым блоком. Резекция включает обе истинные голосовые складки, обе ложные голосовые складки, оба окологолосовых пространства, весь щитовидный хрящ, в некоторых случаях надгортанник, иногда один или оба перстневидных хряща. При разделении перстнечерпаловидных суставов крайне важно сохранить возвратные гортанные нервы. Как уже упоминалось выше, для сохранения в послеоперационном периоде нормального глотания крайне важно оставить нетронутыми верхние гортанные сосуды и нерв. Для реконструкции подъязычную кость, корень языка, в некоторых случаях и надгортанник, подшивают к перстневидному хрящу тремя симметричными подслизистыми швами викрилом 1-0.
Осложнения всех органосохраняющих операций сходны. Аспирация и дисфагия обычно встречаются лишь в раннем послеоперационном периоде, но у некоторых пациентов они сохраняются в течение длительного времени, требуя чрескожной гастростомии. Возможно формирование глоточно-кожных фистул, но риск ниже, чем при полной ларингэктомии. При выполнении органосохраняющих открытых методов, например, надперстневидной ларингэктомии, крайне важно, чтобы заново сформированная гортань была отделена от трахеостомы. Невозможность деканулировать пациента в послеоперационном периоде связана либо с повреждением возвратных гортанных нервов, либо с сужением просвета дыхательных путей из-за некачественно выполненной реконструкции. Наконец, при тотальной (полной) ларингэктомии удаляется вся гортань, подъязычная кость и несколько колец трахеи (в зависимости от распространения опухоли в подскладочный отдел). При выполнении полной ларингэктомии дыхательный тракт и пищеварительный тракт полностью отделяются друг от друга. Эффективность данной операции проверена временем, с ее помощью можно добиваться превосходных онкологических результатов. При наличии у пациента жалоб на затруднение дыхания, операция обычно начинается с трахеотомии, которая выполняется под местной анестезией. Чаще всего рекомендуется выполнение «верхней» трахеотомии, т.к. часть трахеи удаляется вместе с гортанью. При локализации первичного очага в надсвязочном отделе, либо при диагностированных метастазах в лимфоузлы, сначала выполняется двусторонняя шейная лимфодиссекция. При N0 достаточно выполнения двусторонней селективной лимфодиссекции. Затем разделяют надподъязычные и подподъязычные мышцы, верхний констриктор разделяется на уровне латеральной пластинки щитовидного хряща. Свободным элеватором вверху отслаивается слизистая оболочка грушевидных карманов, учитывая возможность использования для последующего сшивания глотки. Затем идентифицируют верхние и нижние паращитовидные железы и отводят их вбок на стороне первичного поражения, чтобы сохранить нижнюю щитовидную артерию. Со стороны первичного поражения обычно включается и доля щитовидной железы. Противоположная доля железы отсепаровывается от трахеи электрокоагулятором, при этом необходимо сохранить питающую ножку верхнего полюса и нижнюю щитовидную артерию. После разделения надподъязычных мышц мобилизуется подъязычная кость, большие рога отделяются от окружающих мягких тканей. При мобилизации верхнего рога в латеральном направлении нужно сохранить поъязычный нерв. Если трахеотомия уже выполнена, трахея рассекается на уровне трахеостомы. На трахею накладываются две 2-0 полипропиленовые лигатуры, чтобы предотвратить ее смещение в средостение. Задняя стенка трахеи отсепаровывается либо скальпелем № 15, либо коагулятором Bovie для создания «простенка» между пищеводом и трахеей. Место входа в глотку зависит от результатов предоперационной фиброскопии или непрямой ларингоскопии. Как правило, хирургу следует вскрыть глотку в месте, не затронутом опухолевым ростом, т.к. это позволит выделять гортань под контролем зрения. Этим местом могут быть валлекулы, грушевидные синусы или слизистая позадиперстневидной области. Наиболее быстрым вариантом является доступ через валлекулы. Определить нужное место рассечения глотки можно пропальпировав валлекулы пациента через ротоглотку аспиратором или небольшим крючком. После рассечения слизистой оболочки глотки, надгортанник берется на зажим. Хирург, стоя у изголовья пациента, изогнутыми ножницами рассекает глоточно-надгортанную складку, осторожно оставляя вокруг опухоли участок здоровых тканей. Разрез продолжается книзу. Размер сохраненной слизистой оболочки грушевидных синусов зависит от степени распространенности опухоли. Затем, после рассечения слизистой оболочки позадиперстневидной области, гортань может быть удалена. Если статус границ резекции неясен, следует отправить ткань с краев резекции на экспресс-исследование (также отправляются границы резекции на уровне трахеи). Для сохранения просвета трахеостомы в послеоперационном периоде выполняется пластика стомы (особенно важно, если в дальнейшем пациенту планируется проводить лучевую терапию). Одним из возможных вариантов является модифицированная W-пластика. Трахея рассекается вдоль двух колец по средней линии. Кожа вокруг стомы рассекается в форме буквы W. 2-0 полипропиленовыми нитями трахея подшивается к коже полупогружными матрацными швами. Затем, при помощи 2-0 полипропиленовых швов и 2-0 полиглактин 910 формируется нижняя часть стомы. Перед ушиванием глотки рассекается перстнеглоточная мышца. Если в дальнейшем планируется выполнение трахео-эзофагеальной пункции, на заднюю стенку трахеи ниже 1 см будущей стомы накладывается зажим. Затем в пищевод устанавливается резиновый катетер размером 14F. В некоторых центрах для питания в раннем послеоперационном периоде устанавливают назогастральный зонд, но при грамотном уходе питание может осуществляться и через катетер, который легче переносится больными, чем назогастральный зонд.
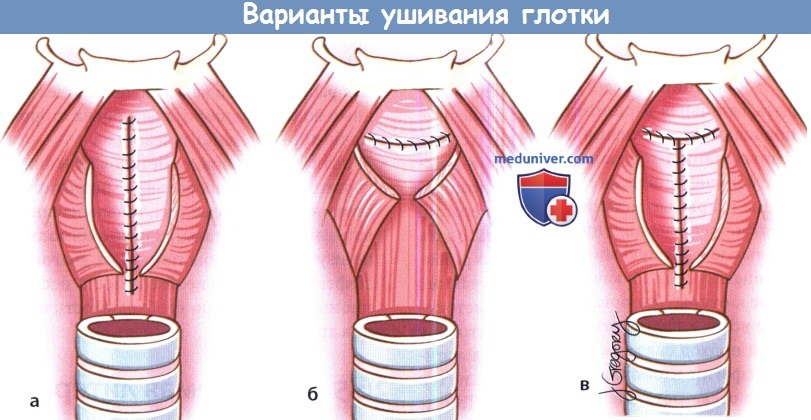
Методика ушивания глотки зависит от разных факторов (количество слизистой оболочки, предоперационная лучевая терапия, предпочтения хирурга). При наличии достаточного объема слизистой возможно вертикальное ушивание глотки обратным швом по Connel. Первый шов накладывается на уровне корня языка, затем слизистая глотки ушивается книзу по вертикали. По мере продвижения хирурга книзу опытный ассистент должен выворачивать края слизистой грушевидных синусов. Горизонтальное наложение швов обычно представляет большую сложность, особенно ближе к центру, поскольку здесь натяжение тканей максимально, особенно в центре Недостатком Т-образного ушивания глотки является образование трифуркации в центре (самое слабое место шва, где натяжение максимально). Но при правильном исполнении все три данных метода дают хорошие результаты. Для дополнительного укрепления глоточного шва возможно сшивание над ним волокон нижнего констриктора глотки вворачивающим швом, но данный метод увеличивает вероятность развития послеоперационной дисфагии. Для исключения просачивания слюны при помощи шприца в глотку вводится метиленовый синий. Места, в которых появился краситель, дополнительно ушиваются вворачивающим швом. Вне зависимости от метода ушивания глотки необходим тщательный послеоперационный уход для минимизации риска развития свища. Фибриновый клей, нанесенный на шов, также может снизить риск формирования фарингостомы. Если пациенту перед операцией проводилась лучевая терапия, реконструкция может выполняться по той же схеме, что была описана выше. Даже при достаточном объеме слизистой оболочки грушевидных синусов можно использовать другие методы реконструкции: пектораль-ный мышечно-кожный лоскут, свободный лучевой лоскут предплечья, свободный антеролатеральный лоскут бедра. Преимуществом этих методик является снижение риска формирования стриктур пищевода и глоточно-кожных фистул. Несколько групп исследователей описали успешное использование мышечного пекторального лоскута для профилактики формирования фарингостом у пациентов, которым выполняется «ларингэктомия отчаяния». Существуют различные методики восстановления голоса после ларингэктомии. У отобранных пациентов тра-хео-пищеводная пункция позволяет добиться появления понятной пищеводной речи. Кандидаты на выполнение трахеопищеводной пункции должны иметь хорошее (или корректируемое) зрение, хорошую координацию движений, а также быть надежными в плане послеоперационного наблюдения, т.к. клапаны требуется регулярно менять и чистить. Также существуют системы с режимом «свободные руки при разговоре», позволяющие говорить без закрытия клапана пальцем. Другим вариантом является использование аппарата «электрогортань», которая продуцирует «механический» голос при установке аппарата на шею или в полость рта (для последнего требуется специальный адаптер). Традиционно пациентам с рецидивом или сохранением заболевания после курса химиотерапии выполнялась тотальная ларингэктомия. Но в последние годы появляются сообщения о том, что у тщательно отобранных пациентов данной группы можно использовать эндоскопические лазерные или органосохраняющие открытые методики. В качестве операции отчаяния Steiner и соавт. предлагают использовать трансоральную лазерную микрохирургическую резекцию. Holsinger и соавт. в качестве операции отчаяния прибегают к открытым органосохраняющим методикам, чаще всего к надперстневидной ларингэктомии; но данный подход связан с увеличением риска аспирации, дисфагии и обструкции дыхательных путей вследствие отека оставшейся части гортани. Тем не менее, специалист по хирургии головы и шеи всегда должен помнить о существовании данных подходов в лечении рецидивирующих опухолей гортани.
Лимфодиссекция при раке гортани. Решение о выборе метода воздействия на лимфоузлы шеи зависит от стадии первичной опухоли по системе TNM, пораженного отдела гортани, метода воздействия на первичную опухоль. На ранних стадиях рака голосового отдела относительно редко развиваются метастазы в регионарные лимфоузлы, поскольку лимфотток от этой области достаточно беден. У пациентов с раком голосового отдела гортани ранней стадии и статусом лимфоузлов N0 разумной стратегией является простое динамическое наблюдение. Надсвязочный отдел, напротив, характеризуется богатым двусторонним лимфоттоком в узлы яремно-двубрюшной цепи. И хотя в отдельных случаях опухоли Т1 можно прибегнуть к консервативной тактике, большинству пациентов с более распространенными опухолями необходимо селективное воздействие на лимфоузлы шеи (или хирургическое уровней II, III и IV, или лучевое, включающее зоны риска), вне зависимости от данных клинического осмотра. Если в лечении первичного очага использовалась лучевая терапия, центральные и латеральные лимфоузлы шеи также следует включать в поле облучения. При статусе лимфоузлов N+ выполняется соответствующая шейная лимфодиссекция. Ключевые моменты:
– Также рекомендуем “Показания и методика трансоральной роботизированной хирургии (TORS)” Оглавление темы “Болезни слюнных желез и гортани”:
|
Источник