Лечение постинтубационного стеноза гортани
С ростом дорожно-транспортного травматизма, природных и промышленных катастроф, обострения криминальной обстановки, отмечается увеличение числа больных, нуждающихся в интубации (И). Длительная (И), трахеостомия (Т), выполняемые по витальным показаниям в отделениях интенсивной терапии для адекватной вентиляции легких, у части больных являются причиной стенозирования гортани и трахеи. До настоящего времени нет единой классификации постинтубационных стенозов воздухопроводящих путей. Потому мы решили представить свой многолетний опыт лечения больных данной патологией.
Под нашим наблюдением с 1990 по 1999гг. было 450 пациентов в возрасте от 15 до 77 лет, из них 235 мужчин и 215 женщин. Все они находились на лечении в отделениях реанимации больницы им. С.П. Боткина. Причинами реанимационных мероприятий у 270 больных был дорожно-транспортный травматизм, сопровождающийся множественными переломами, черепно-мозговой травмой, массивной кровопотерей и т.д. У 90 пациентов, этими причинами были производственные и бытовые травмы. Тяжелые соматические заболевания такие, как: тяжелые пневмонии, некупирующиеся приступы бронхиальной астмы и эпилепсии, нарушения мозгового кровообращения, инфаркты, патология в родах, острый панкреатит, желудочно-кишечные кровотечения, отравления и др. были у 60 пациентов. У 30 больных причиной (И) были ножевые и огнестрельные ранения жизненно важных органов.
В зависимости от сроков, прошедших после (И) все больные были разделены нами на 2 основные группы: с ранними стенозами (до 3 мес. после ИВЛ): и поздними (более 3 мес.). В первой группе было -250 больных, а во второй – 200. Такое разделение больных мы объясняли степенью патологических изменений, происходящих в гортани и трахее на фоне (И). Если в 1 группе они имели вид мягкотканных образований – “козырька” по верхнему краю трубки, грануляций, суживающих просвет гортани и трахеи, то во 2 – имели место рубцовые деформации и атрезии просвета. Поэтому тактика, длительность и эффективность лечения в группах была различной.
В каждой группе мы выделили по 3 подгруппы. Определяющим моментом для разделения был вид (И), проводимый больным. В 1 подгруппе были пациенты, перенесшие оро- или назооральную (И), -40, во 2 – (И), (Т), и впоследствии деканулированные – 130. В 3 – больные после (И), (Т), и в силу объективных причин, оставшиеся канюлярами – 280.
Уровни стенозирования в каждой подгруппе были различными. В 1 патологические изменения локализовались в складково-подскладком отделе гортани и в начальном шейном трахеи, т.е. на уровне 1-2 ее колец. Они имели вид отечного ларингита, одно или двустороннего пареза гортани, интубационной гранулемы, грануляций в подскладковом и начальном шейном отделе трахеи. Для диагностики перечисленных изменений применяли непрямую ларингоскопию, томографию гортани и шейного отдела трахеи, а также эндофиброскопическое исследование воздухопроводных путей (ЭФС).
У больных 2 подгруппы кроме отмеченных выше были зарегистрированы мягко тканный или в зависимости от сроков после (ИВЛ), рубцовый “козырек” по верхнему краю стомы, сужение передне-заднего размера шейного отдела трахеи на уровне бывшей трахеостомы, после трахеостомии по Бьерку, стенозирование грудного отдела трахеи, на месте фиксации раздувной манжетки трахеотомической трубки. Для диагностики суженных участков кроме перечисленных выше методов необходимо было провести рентгено-томографическое обследование средостения.
В третьей подгруппе у части больных была диагностирована атрезия шейного отдела трахеи от стомы до гортани, а также уровни сужения, аналогичные во 2 группе. Характер патологических изменений зависел от сроков, прошедших после (И). Лечение больных с грубыми и протяженными рубцовыми деформациями состояло из 3-4 этапов, длительность которого у некоторых пациентов составляла 4 года.
В ! группе т.е. у больных с ранними постинтубационными стенозами из 250 было 180 канюленосителей, 50 – после интратрахеальной (И) и деканулированных в профильных отделениях больницы, остальные 20 перенесли оро- или назооральную (И). При выявлении у канюленосителей воспалительных изменений в складково-подскладковом отделах гортани назначали им антибактериальную, противоотечную, десенсибилизирующую терапию, ингаляции с гидрокортизоном, физиопроцедуры на область гортани. Ежедневно меняли трахеотомические трубки с гормональной мазью. После стихания воспалительных изменений в гортани назначали фонопедическую гимнастику. Выявленные в просвете гортани или трахеи мягкотканные образования удаляли с помощью гибких эндоскопов с набором специального инструментария. Контрольное ЭФС обследование просвета гортани и трахеи проводили через 5-7 дней после удаления образований, и при отсутствии их рецидива осуществляли поэтапную декануляцию. В случаях повторного роста грануляций, суживающих просвет трахеи ниже этого уровня проводили термопластическую трубку, с которой выписывали больных для дилятации просвета на 6-8 мес.
Из 180 канюляров, лишь 10 нуждались в повторной госпитализации в отделение восстановительной ЛОР-хирургии для проведения им поэтапного хирургического лечения. После традиционного лабораторного, рентгенотомографического, эндофиброскопического обследования больных, преодоперационного осмотра терапевта и при показаниях невропатолога. За 2 дня до операции назначали пациентам внтримышечно введение антибиотиков широкого спектра действия и кровоостанавливающие препараты (дицинон или этамзилат натрия). Операцию проводили под эндотрахеальной анестезией. По отработанным в отделении методикам производили различные модификации ларинготрахеопластик, направленных на расширение суженных участков гортани и трахеи, оформляли стойкую ларинготрахеостому, в просвет которой вводили Т-образную силиконовую трубку. В послеоперационном периоде на фоне антибактериальной и гемостатической терапии добавляли противоотечную, десенсибилизирующую и анальгезирующую терапию. До 7 дня после операции ежедневно перевязывали больных со спиртом, трубку меняли на 5-7 день. Через 10-14 дней выписывали больных на 6-8 для дилятации сформированного просвета. При повторном поступлении после необходимого обследования и контрольного периода (7-10 дней без Т-трубки), при показаниях ушивали трахеальный дефект. Из-за обширных хондромаляций грудного отдела трахеи 4 пациентов остаются канюленосителями.
Пациентам, поступавшим в отделение по витальным показаниям, перенесшим длительную ИВЛ, трахеостомию и деканулированные в профильных отделениях больницы (50) после перечисленного выше обследования производили ретрахеостомию с элементами трахеопластики. Ввиду невозможности проведения им эндотрахеальной анестезии, операцию производили под местной анестезией.
Технические сложности операции были обусловлены тяжелым состоянием больного, связанного с декомпенсацией дыхания, рубцовыми изменениями тканей переднего отдела шеи, смещением трахеи от средней линии и др. У 17 пациентов после вскрытия просвета трахеи не отмечали улучшения дыхания в связи с наличием у них стеноза грудного отдела трахеи на уровне фиксации раздувной манжетки трахеотомической трубки. Уровень и степень сужения определяли с помощью гибких эндоскопов. Диаметр просвета суженного участка трахеи не превышал 3-4 мм. Расширяли трахею интубационными трубками, и в момент операции ее диаметр доводили до 7 мм. После оформления стойкой трахеостомы ниже уровня сужения проводили удлиненную термопластическую трубку или расщепленный зонд. Послеоперационное ведение больных было аналогичным описанному выше, трубку меняли ежедневно. На 2-3 после операции вводили трубку диаметром 8мм., постепенно доводили его до 10мм., после чего выписывали больных на 8-10 мес. для дилятации просвета трахеи.
Пациентам со стенозами шейного и начального грудного отдела трахеи в сформированный просвет вводили Т-образную силиконовую трубку, и на 10-14 день после операции выписывали для дилятации просвета на 6-8 мес. При повторном поступлении после проведения больным контрольного периода и традиционного обследования при показаниях ушивали трахеальный дефект. Из 50 больных полностью реабилитированы 47, трое остаются хроническими канюлярами из-за хондромаляций грудного отдела трахеи.
У пациентов, перенесших длительную оро- или назотрахеальную (И) -20 патологические изменения были зарегистрированы на уровне складково-подскладковом отделах гортани и начальном отделе трахеи.
Диагностировали перечисленные изменения при непрямой ларингоскопии боковой рентгенографии гортани и трахеи. Больным с постинтубационными гранулемами (3) произодили их эндоларингеальное удаление с помощью удаление операционного микроскопа. Остальным 17 была произведена трахеостомия под местной анестезией. Послеоперационое ведение больных не отличалось от описанного выше. Пациентов обучали самостоятельной смене трубок, и на 7-10 выписывали с рекомендацией повторного поступления в отделение через 3 месяца. На 2 этапе лечения больным производили различные варианты ларинготрахеопластик с редрессацией “печатки” перстневидного хряща, аритеноидхордэктомии и др., в сформированный просвет вводили Т-образную силиконовую трубку с закрытым верхним концом, для исключения попадания жидкой пищи в трахею. Послеоперационное ведение было традиционным, трубку меняли на 7 день при этом следили, чтобы открытый ее верхний конец был фиксирован между голосовыми складками. Больных выписывали на 14-17 после операции с рекомендацией ежедневных перевязок и еженедельной смене Т-трубок. При повторном поступлении после проведения контрольного периода и предоперационного обследования при показаниях ушивали трахеальный дефект. Все больные этой подгруппы полностью реабилитированы.
Разработанные в отделении методы диагностики и лечения больных с ранними постинтубационными стенозами гортани и трахеи позволили из 250 больных реабилитировать 243, т.е. около 95%.
У больных 2 группы с поздними (более 3 мес. прошедших после ИВЛ) постинтубационными стенозами гортани и трахеи (200) патологические изменения имели вид рубцовых деформаций, стенозов, атрезий. Больные, поступавшие в отделение с трахеотомическими трубками (100), предъявляли жалобы на афонию, невозможность дыхания без трахеотомической трубки. У 19 пациентов затрудненное дыхание при наличие трубки. При рентгенотомографическом обследовании гортани, трахеи и средостения, а также ЭФС исследовании были зарегистрированы следующие патологические изменения: срединное положение голосовых складок, как проявление анкилоза черпало-перстневидных суставов, рубцовые сужения вплоть до атрезии шейного отдела трахеи от верхнего края стомы до голосовых складок, рубцовые сужения на уровне стомы, рубцовые сужения грудного отдела трахеи на уровне фиксации раздувной манжетки трахеотомической трубки, а также по нижнему краю трахеотомической трубки. Лечение больных с затрудненным дыханием при наличии трубки начинали с расширения суженного просвета грудного отдела трахеи с помощью интубационных трубок. Дальнейшая тактика ведения больных описана выше.
Тактика хирургического лечения больных с поздними рубцовыми сужениями практически не отличалась от таковой у больных с ранними стенозами.
Устранение поздних грубых рубцовых сочетанных деформаций было более сложным, чем ранних. Сроки дилятации просвета гортани и трахеи превышали идентичные в 1 группе на 8-12 месяцев, этапность лечения увеличилась на 1-2 этапа. Из 100 больных – 17 остаются хроническими канюлярами в силу преклонного возраста (пациенты старше 70 лет) в связи с наличием у них тяжелой сопутствующей патологии – 8- больных, остальные 9 с грубыми рубцовыми деформациями грудного отдела трахеи направлены для дальнейшего лечения в отделения грудной хирургии.
Пациенты, перенесшие до поступления в отделение интубацию, трахеостомию и деканулированные (80) жаловались на затрудненное дыхание. При рентгено-томографическом и ЭФС гортани и трахеи у больных отмечены рубцовые деформации от складкового отдела гортани до грудного отдела трахеи. У большинства больных прямая ларингоскопия была не информативна, голосовая щель была у них широкой подскладковое пространство свободным.
Поэтому они нередко госпитализировались в терапевтические отделения с диагнозами обструктивный бронхит, пневмония, бронхиальная астма и. др. Лечение начинали с проведения ретрахеостомии с элементами трахеопластики. Операцию проводили под местной анестезией. В сформированный просвет вводили Т-образную силиконовую трубку, тактика послеоперационного ведения была обычной. В случаях выявления у больных стеноза грудного отдела суженные участки грудного отдела трахеи также расширяли с помощью интубационных трубок. Лечение пациентов этой подгруппы также было на 1-2 этапа больше, чем аналогичных в первой группе, а сроки дилятации грудного отдела трахеи достигали 48 мес. Из 80 больных полностью реабилитированы 70, остальные 10 остаются хроническими канюлярами из-за обширных хондромаляций грудного отдела трахеи.
У всех 20 больных, перенесших оро- или назотрахеальную интубацию зарегистрированы рубцовые деформации на уровне складково-подскладкового отдела гортани и начального отдела трахеи. Хирургическое лечение начинали с трахеостомии с последующими, описанными выше этапами лечения. Сроки лечения больных также были более длительными по сравнению с 1 группой, этапность лечения более на 1 этап. Реабилитированы все пациенты этой подгруппы. При сравнении результатов реабилитации больных с ранними и поздними стенозами гортани и трахеи выявлены следующие закономерности:
1. При переводе больных, находящихся в отделении реанимации на самостоятельное дыхание проведение ЭФС обследование позволяло выявить тенденции к стенозированию гортани и трахеи, а также своевременно их устранить с помощью гибких эндоскопов и избежать формирование рубцевания воздухопроводных путей;
2. Проведение поэтапной декануляции, динамический ЭФС контроль за состоянием просвета гортани и трахеи способствуют профилактике их стенозирования.
3. Уровень стенозирования гортани зависит от вида интубации: при назотрахеальной страдают гортань и начальный шейный отдел трахеи, при интратрахеальной (И) – шейный и грудной отделы трахеи.
4. При поступлении больных с затрудненным дыханием необходимо выявлять момент интубации.
5. Пациентам, перенесшим интубацию необходимо проводить
рентгенотомографическое трахеи и средостения, а также ЭФС гортани и трахеи.
6. Эффективность лечения больных с постинтубационными стенозами гортани и трахеи после назотрахеальной (И) составляет до 100%, что объясняется отсутствием повреждений грудного отдела трахеи.
7. Показатели реабилитации пациентов, перенесших (И), канюленосителей составили соответственно 98% и 83%, однако этапность и сроки лечения у 2 группы больных были значительно больше.
8. Показатели реабилитации больных с ранними и поздними стенозами, перенесших (И), трахеостомию и деканулированных составили 94% и 68%.
9. Невозможность полной реабилитации больных, перенесших длительную интратрахеальную интубацию объясняется развитием хондромаляций грудного отдела трахеи.
10. Успешная реабилитация больных с постинтубационными стенозами гортани и трахеи во многом зависит от совместных квалифицированных усилий реаниматологов, эндоскопистов и ЛОР-врачей.
Таблица 1. Показатели реабилитации больных с постинтубационными стенозами гортани и трахеи
No
Подгруппы больных
Больные с ранними постинтубационными стенозами гортани и трахеи
Больные с поздними постинтубационными стенозами гортани и трахеи
1
После оро-трахеальной интубации
20
20
Реабилитировано
20
20
2
Деканулировано
50
80
Реабилитировано
47
70
3
Канюленосители
180
100
Реабилитировано
176
83
Всего
243
173
В.Н. ФОЛОМЕЕВ
Источник
Оглавление темы “Стенозы гортани и трахеи”:
Методы лечения стеноза гортани и трахеи без операции и с операциейа) Консервативное лечение стеноза гортани и трахеи. Перед проведением хирургического лечения необходимо добиться компенсации всех имеющихся сопутствующих заболеваний: обструктивного апноэ, диабета, ларингофарингеального рефлюкса, ожирения. Лечение системных воспалительных заболеваний проводится у соответствующего специалиста. Могут применяться топические, ингаляционные и системные кортикостероиды. Длительное использование пероральных кортикостероидов сопряжено с развитием ряда тяжелых побочных эффектов, к которым относятся кушинго-идность, гипергликемия, обострение депрессии или тревоги, акне, повышение внутриглазного давления, раздражение желудочно-кишечного тракта, асептический некроз головки бедренной кости. Для купирования обострения стеноза дыхательных путей полезно применение рацемического адреналина и гелиокса. Также под руководством грамотного фонопеда должны проводится упражнения, которые помогают пациенту адаптировать его голосовые привычки к ограничениям, связанным с имеющимся стенозом. б) Хирургическое лечение стеноза гортани и трахеи. Если принято решение о проведении хирургического лечения, необходимо принять во внимание следующие факторы: локализация,протяженность и характер (мягкотканный или фиброзный) стеноза; наличие динамической маляции; сочетанное нарушение подвижности голосовых складок; выраженность функциональных нарушений; сопутствующие медицинские состояния. Наиболее распространенным методом лечения ларинготрахеального стеноза всех уровней является эндоскопический. Основным недостатком лазерного иссечения или абляции рубца является то, что в результате данных процедур образуется обнаженная послеоперационная рана, на месте которой может вновь образоваться рубец, требующий проведения повторной операции. Примерно 75% пациентам, которым при первичном лечении было выполнено эндоскопическое расширение дыхательных путей, потребуется проведение второй операции по поводу рецидива стеноза. Наиболее подходящими кандидатами для проведения эндоскопической операции являются следующие категории пациентов: со стенозом на уровне надсвязочного пространства или голосовой щели, подскладочным стенозом I или II типа по Cotton-Myer, мягким или незрелым рубцом трахеи минимальной толщины (менее 1 см). Эндоскопическая операция проводится в качестве первого вмешательства, при ее неэффективности прибегают к открытым доступам. Все открытые хирургические вмешательства можно разделить на две большие группы: резекцию и расширение. При резекции стенозированный участок удаляется. При расширении увеличение просвета дыхательных путей происходит за счет того, что их стенка рассекается, а на нее укладывается хрящевой трансплантат (чаще всего реберный аутотрансплантат).
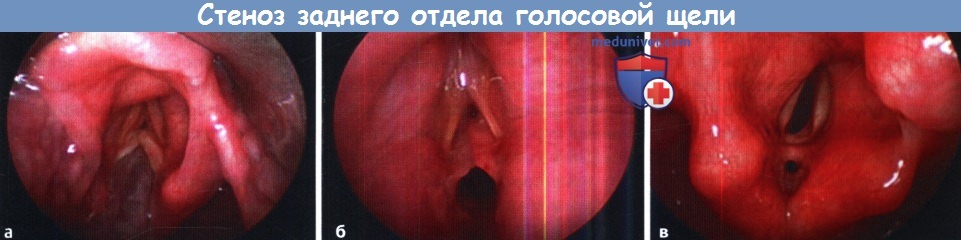
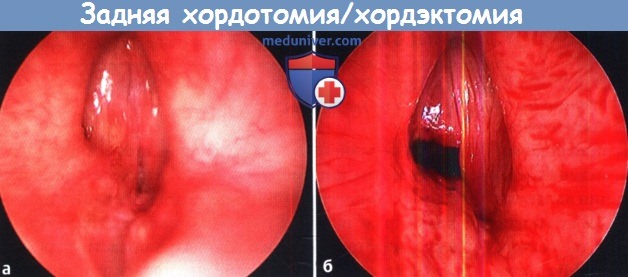
1. Операция при надскладочном стенозе гортани. Надскладочный стеноз встречается редко. Чаще всего он развивается в результате травмы, приема едких жидкостей, либо инфекционного процесса. Иногда успешным оказывается эндоскопическая лазерная абляция патологических тканей. Если стеноз рецидивирует, прибегают к открытому доступу либо посредством чрезподъязычной фаринготомии, либо методом ларингофиссуры. Нужно стараться удалить рубцовую ткань, при этом максимально сохранив слизистую оболочку. Дефекты слизистой оболочки нужно укрыть слизистыми лоскутами. При необходимости для дополнительной пластики дефекта слизистой можно взять трансплантат со щеки. В процессе заживления применяется гортанный стент. В качестве альтернативной операции может использоваться надскладочная ларингэктомия. 2. Лечение стеноза голосовой щели гортани: – Операции при стенозе переднего отдела голосовой щели/рубцовая мембрана. Стеноз переднего отдела голосовой щели может быть врожденным и приобретенным. У взрослых чаще всего имеет ятрогенную природу, когда операция проводилась сразу на обеих голосовых складках. В результате развивается рубцовый процесс в области передней комиссуры. Доступ может применяться как эндоскопический, так и открытый. Если протяженность стеноза под голосовую щель составляет менее 5 мм, иссечь рубцовую мембрану можно либо лазером, либо хирургическим микроинструментарием. Изолированное иссечение рубца редко приводит к хорошему результату. Дополнительно может выполняться введение кортикостероидов в область стеноза, топические аппликации митомицина С, эндоскопическая установка силастиковой пластинки, которая удаляется через 2-4 недели. Если рубец продолжается в подскладочное пространство на значительную длину, выполняется передняя ларингофиссура с резекцией рубца, укрытием дефекта слизистыми лоскутами и установкой мягких гортанных стентов. – Лечение стеноза заднего отдела голосовой щели. При стенозах заднего отдела голосовой щели также возможно применение и эндоскопических, и открытых доступов. Выбор доступа зависит от степени поражения заднего отдела голосовой щели, согласно классификации по Bogdasarian и Olson. При I типе выполняют эндоскопическое рассечение синехий межчерпаловидной области. У этой группы пациентов прогноз в отношении декануляции благоприятный, также высока вероятность восстановления нормальной подвижности голосовых складок. При типах II и III применяется эндоскопическое лазерное рассечение рубца с пластикой дефекта перемещаемым лоскутом с задней поверхности слизистой оболочки перстневидного хряща. IV тип является наиболее тяжелым, для него характерен двусторонний анкилоз перстнечерпаловидных суставов с рубцеванием и контрактурой межчерпаловидного пространства. При помощи лазерной задней хордотомии можно значительно увеличить просвет заднего дыхательного отдела голосовой щели, при этом фонаторная функция сохраняется, т.к. передние отделы голосовой щели остаются интактными. Если требуется дополнительная резекция тканей, возможно проведение открытой или эндоскопической аритеноидэктомии. Правда, у некоторых пациентов, перенесших резекцию латеральной порции черпаловидных хрящей, в послеоперационном периоде возникает дисфагия. Перед проведением такой операции пациентов важно предупредить о том, что дыхание улучшится за счет некоторого ухудшения функции глотания. Открытым доступом возможно выполнение заднего расщепления перстневидного хряща с установкой реберного расширяющего трансплантата, который увеличивает просвет межчерпаловидного пространства. В случае, если после резекции рубца открытым доступом возможно восстановление подвижности черпаловидных хрящей, на задний отдел голосовой щели можно уложить щечный слизистый трансплантат или передвижной глоточный лоскут, которые позволяют предотвратить рестенозирование и восстановить просвет голосовой щели, но при этом не приводят к нарушению функций фонации и глотания.
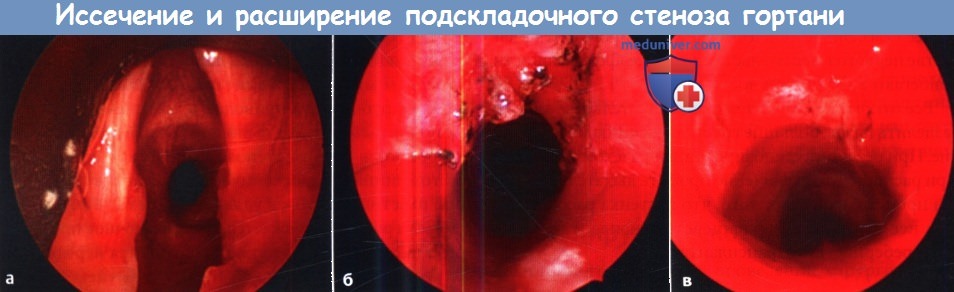
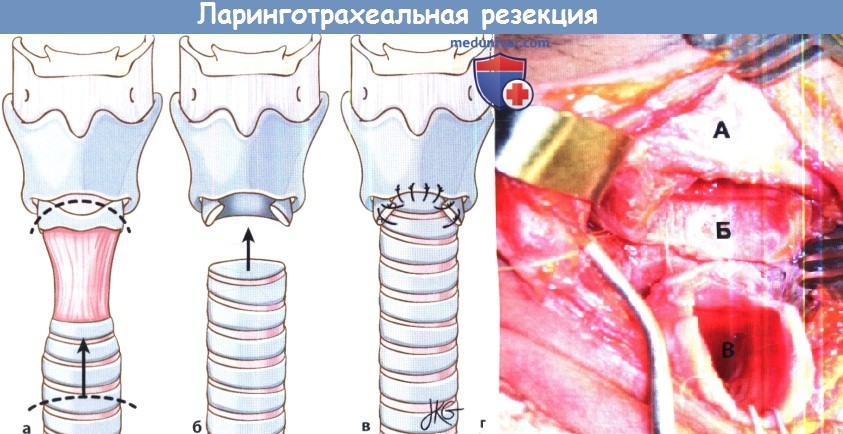
в) Операции для лечения подскладочного стеноза гортани: 1. Эндоскопические методы. Наиболее часто выполняется эндоскопическое радиальное рассечение рубца с последующей дилатацией. Рубец иссекается либо лазером, либо острым инструментарием. Дилатация может выполняться как пневматически, так и жестким инструментом. Теоретически, при выполнении радиального рассечения рубца можно сохранить промежутки здоровой слизистой оболочки, которые будут способствовать более быстрой реэпителизации в послеоперационном периоде и замедлят повторное формирование рубца. К дополнительным методам относят топическое применение митомицина С, который наносится на расширяемую область. Митомицин С представляет собой цитостатический антибактериальный препарат, который получают из бактерии Streptomyces caespitosus. Он способен подавлять пролиферацию фибробластов. Согласно данным одного исследования, применение митомицина С во время эндоскопического иссечения рубца статистически достоверно повышает вероятность успешности операции с 20% до 75%. К сожалению, другие исследования ставят эффективность митомицина С под вопрос. Также его применение связано с определенными осложнениями, например, образованием корок (которые могут приводить к обструкции дыхательных путей) и определенным риском малигнизации. К другим дополнительным методам лечения относятся топические и системные кортикостероиды, антибактериальная терапия в периоперационном периоде, анти-секреторные препараты. К сожалению, даже несмотря на вышеперечисленные меры, повторный стеноз развивается достаточно часто. 2. Переднее расщепление перстневидного хряща. Эта операция является формой расширения гортани и трахеи. Впервые она была описана как альтернатива трахеотомии у недоношенных детей с врожденным подскладочным стенозом. Передняя поверхность перстневидного хряща и два верхних кольца трахеи рассекаются, за счет чего перстневидный хрящ несколько раздвигается. В некоторых случаях пациент должен оставаться интубированным в течение 10 дней после операции, но вот выполнения трахеотомии лучше избегать. 3. Передняя и задняя ларинготрахеопластика. Передняя и задняя ларинготрахеопластика также являются операциями по расширению просвета гортани и трахеи. Чаще всего их применяют при подскладочных стенозах III и IV типов, а также при неэффективности эндоскопических методов лечения. Доступ осуществляется через ларингофиссуру. Переднее и/или заднее кольцо перстневидного хряща рассекаются вдоль средней линии, после чего устанавливаются хрящевые трансплантаты, которые поддерживают хрящевой остов гортани и трахеи в расширенном состоянии. Хрящевые трансплантаты забираются из ребра или из перегородки носа. Для проведения данной операции обычно требуется трахеотомия и установка внутрипросветных стентов, служащих для поддержки трансплантатов. 4. Крикотрахеальная резекция. В случае, если рубец локализуется в подскладочном пространстве, но при этом не затрагивает голосую щель (так, что небольшой «вход» в подскладочное пространство остается свободным), можно провести крикотрахеальную резекцию. В ходе этой операции удаляется рубцовая ткань с передней поверхности перстневидного хряща, а интактная трахея подшивается к задней поверхности перстневидного хряща, с которой была частично удалена слизистая оболочка. Некоторые хирурги предпочитают накладывать «шов Grillo», от подбородка до кожи грудины, который помогает пациентам не разгибать шею, не создавая, таким образом, ненужного натяжения в области анастамоза. При правильном подборе пациентов успешность операции превышает 90%. У большинства из этих пациентов в дальнейшем разовьются те или иные изменения голоса, которые могут быть постоянными.
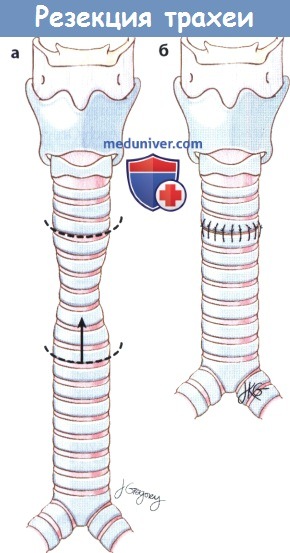
г) Операции для лечения стеноза трахеи: 1. Эндоскопические методики. Эндоскопические операции, применяющиеся при стенозе трахеи, в целом аналогичны таковым при подскладочном стенозе. Для рассечения или резекции рубца используется лазер или микроинструментарий, а дилатация выполняется либо пневматическим методом, либо жесткими инструментами. Дополнительно применяются митомицин С, кортикостероиды системно и местно, антибиотики и антисекреторные препараты. 2. Т-трубки и стенты. У пациентов с изолированным стенозом трахеи или подскладочного отдела гортани при сохраненной голосовой функции можно рассмотреть возможность применения стентов. Целесообразность использования стентов для лечения доброкачественного стеноза трахеи остается под вопросом. И хотя установка стента непосредственно увеличивает просвет дыхательных путей, существует ряд серьезных факторов, ограничивающих их применение: образование слизистых пробок, формирование грануляционной ткани, смещение стента, расхождение травмированных колец трахеи. Чаще стенты применяются в некоторых случаях злокачественной обструкции дыхательных путей и при неоперабельных опухолях, а также в редких случаях в качестве временной меры после хирургической резекции рубца. У тщательно отобранных пациентов, которым требуется восстановление проходимости дыхательных путей, но которые не желают использовать трахеотрубку, либо у тех пациентов, у которых использование трахеотрубки невозможно из-за того, что рубец расположен над стомой или в подскладочном пространстве, могут использоваться Т-трубки. Они расширяют просвет дыхательных путей и снизу, и сверху от стомы. Трубка устанавливается через имеющееся трахеотомическое отверстие, протяженность должна соответствовать протяженности рубца и/или деформированного фрагмента трахеи. Наружная часть Т-трубки предотвращает ее смещение, также через нее можно проводить санацию трахеи, вводить лекарственные препараты или физиологический раствор. Наружная трубка не используется для дыхания, для того, чтобы пациент мог дышать и говорить, ее нужно держать закрытой. Т-трубки лишены внутренней канюли, поэтому они могут забиваться слизью, особенно в тех случаях, когда для дыхания используется наружная трубка (т.к. воздух не согревается и не увлажняется верхними дыхательными путями). 3. Сегментарная резекция. Если область стеноза или деформированного фрагмента ограничена трахеей, простая резекция с анастамозом конец-в-конец позволяет добиться восстановления нормального дыхания в 90% случаев. Grillo и соавт. опубликовали сообщение о 503 пациентах с постинтубационным стенозом трахеи. У 471 пациента удалось добиться хороших (87,5%) или удовлетворительных (6,2%) результатов. Возможны следующие осложнения: формирование грануляционной ткани, появление дегисценций, травма гортанных нервов, обструкция дыхательных путей, медиастинит, кровотечение, инфицирование, инфаркт миокарда, трахеопищеводная фистула, пневмоторакс, тромбоз глубоких вен, рецидив стеноза и смерть.
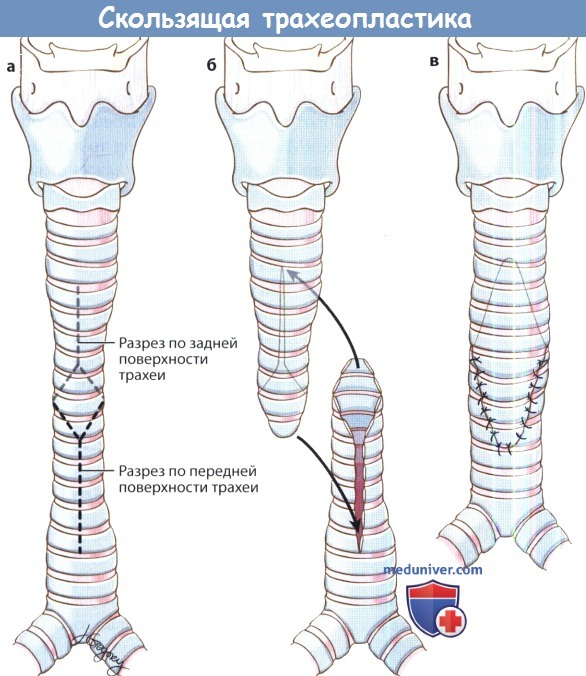
4. Аугментация. Для аугментационной трахеопластики могут использоваться аутотрансплантаты, например, реберный хрящ, надкостница, перикард, мышечные лоскуты на ножке, сложные трансплантаты, пищевод, брюшина или консервированная твердая мозговая оболочка. По нескольким причинам чаще всего применяют хрящ. Он представляет собой жесткую аутоткань, питание которой происходит методом диффузии, поэтому хрящ может приживаться даже в отсутствие непосредственного кровоснабжения. Ход операции в целом аналогичен расширяющей ларинготрахеопластике. 5. Скользящая трахеопластика. В случаях, если проведение сегментарной резекции невозможно из-за протяженности дефекта, может применяться скользящая трахеопластика. Эта операция чаще всего проводится при врожденных стенозах у детей, при травматических стенозах рутинно не используется. Подробный фотографический атлас операций на трехее представлен в отделном этом разделе сайта.
д) Заключение. В данной главе были кратно рассмотрены основные вопросы, касающиеся диагностики и лечения ларинготрахеального стеноза. Выбор метода лечения зависит от протяженности и локализации дефекта. К сожалению, лечение данного состояния остается крайне сложной проблемой, поэтому пациентов нужно информировать об ожиданиях и возможных рисках. Ключевые моменты: – Также рекомендуем “Частота и варианты травм гортани” Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021 |
Источник