Хирургическое лечение стеноза гортани
Оглавление темы “Стенозы гортани и трахеи”:
Методы лечения стеноза гортани и трахеи без операции и с операциейа) Консервативное лечение стеноза гортани и трахеи. Перед проведением хирургического лечения необходимо добиться компенсации всех имеющихся сопутствующих заболеваний: обструктивного апноэ, диабета, ларингофарингеального рефлюкса, ожирения. Лечение системных воспалительных заболеваний проводится у соответствующего специалиста. Могут применяться топические, ингаляционные и системные кортикостероиды. Длительное использование пероральных кортикостероидов сопряжено с развитием ряда тяжелых побочных эффектов, к которым относятся кушинго-идность, гипергликемия, обострение депрессии или тревоги, акне, повышение внутриглазного давления, раздражение желудочно-кишечного тракта, асептический некроз головки бедренной кости. Для купирования обострения стеноза дыхательных путей полезно применение рацемического адреналина и гелиокса. Также под руководством грамотного фонопеда должны проводится упражнения, которые помогают пациенту адаптировать его голосовые привычки к ограничениям, связанным с имеющимся стенозом. б) Хирургическое лечение стеноза гортани и трахеи. Если принято решение о проведении хирургического лечения, необходимо принять во внимание следующие факторы: локализация,протяженность и характер (мягкотканный или фиброзный) стеноза; наличие динамической маляции; сочетанное нарушение подвижности голосовых складок; выраженность функциональных нарушений; сопутствующие медицинские состояния. Наиболее распространенным методом лечения ларинготрахеального стеноза всех уровней является эндоскопический. Основным недостатком лазерного иссечения или абляции рубца является то, что в результате данных процедур образуется обнаженная послеоперационная рана, на месте которой может вновь образоваться рубец, требующий проведения повторной операции. Примерно 75% пациентам, которым при первичном лечении было выполнено эндоскопическое расширение дыхательных путей, потребуется проведение второй операции по поводу рецидива стеноза. Наиболее подходящими кандидатами для проведения эндоскопической операции являются следующие категории пациентов: со стенозом на уровне надсвязочного пространства или голосовой щели, подскладочным стенозом I или II типа по Cotton-Myer, мягким или незрелым рубцом трахеи минимальной толщины (менее 1 см). Эндоскопическая операция проводится в качестве первого вмешательства, при ее неэффективности прибегают к открытым доступам. Все открытые хирургические вмешательства можно разделить на две большие группы: резекцию и расширение. При резекции стенозированный участок удаляется. При расширении увеличение просвета дыхательных путей происходит за счет того, что их стенка рассекается, а на нее укладывается хрящевой трансплантат (чаще всего реберный аутотрансплантат).
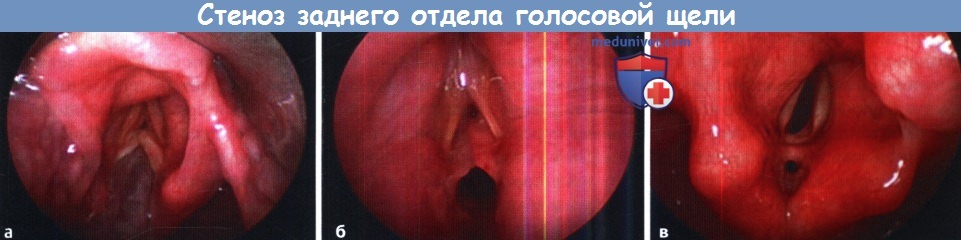
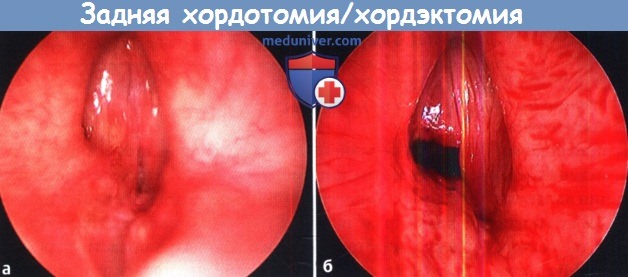
1. Операция при надскладочном стенозе гортани. Надскладочный стеноз встречается редко. Чаще всего он развивается в результате травмы, приема едких жидкостей, либо инфекционного процесса. Иногда успешным оказывается эндоскопическая лазерная абляция патологических тканей. Если стеноз рецидивирует, прибегают к открытому доступу либо посредством чрезподъязычной фаринготомии, либо методом ларингофиссуры. Нужно стараться удалить рубцовую ткань, при этом максимально сохранив слизистую оболочку. Дефекты слизистой оболочки нужно укрыть слизистыми лоскутами. При необходимости для дополнительной пластики дефекта слизистой можно взять трансплантат со щеки. В процессе заживления применяется гортанный стент. В качестве альтернативной операции может использоваться надскладочная ларингэктомия. 2. Лечение стеноза голосовой щели гортани: – Операции при стенозе переднего отдела голосовой щели/рубцовая мембрана. Стеноз переднего отдела голосовой щели может быть врожденным и приобретенным. У взрослых чаще всего имеет ятрогенную природу, когда операция проводилась сразу на обеих голосовых складках. В результате развивается рубцовый процесс в области передней комиссуры. Доступ может применяться как эндоскопический, так и открытый. Если протяженность стеноза под голосовую щель составляет менее 5 мм, иссечь рубцовую мембрану можно либо лазером, либо хирургическим микроинструментарием. Изолированное иссечение рубца редко приводит к хорошему результату. Дополнительно может выполняться введение кортикостероидов в область стеноза, топические аппликации митомицина С, эндоскопическая установка силастиковой пластинки, которая удаляется через 2-4 недели. Если рубец продолжается в подскладочное пространство на значительную длину, выполняется передняя ларингофиссура с резекцией рубца, укрытием дефекта слизистыми лоскутами и установкой мягких гортанных стентов. – Лечение стеноза заднего отдела голосовой щели. При стенозах заднего отдела голосовой щели также возможно применение и эндоскопических, и открытых доступов. Выбор доступа зависит от степени поражения заднего отдела голосовой щели, согласно классификации по Bogdasarian и Olson. При I типе выполняют эндоскопическое рассечение синехий межчерпаловидной области. У этой группы пациентов прогноз в отношении декануляции благоприятный, также высока вероятность восстановления нормальной подвижности голосовых складок. При типах II и III применяется эндоскопическое лазерное рассечение рубца с пластикой дефекта перемещаемым лоскутом с задней поверхности слизистой оболочки перстневидного хряща. IV тип является наиболее тяжелым, для него характерен двусторонний анкилоз перстнечерпаловидных суставов с рубцеванием и контрактурой межчерпаловидного пространства. При помощи лазерной задней хордотомии можно значительно увеличить просвет заднего дыхательного отдела голосовой щели, при этом фонаторная функция сохраняется, т.к. передние отделы голосовой щели остаются интактными. Если требуется дополнительная резекция тканей, возможно проведение открытой или эндоскопической аритеноидэктомии. Правда, у некоторых пациентов, перенесших резекцию латеральной порции черпаловидных хрящей, в послеоперационном периоде возникает дисфагия. Перед проведением такой операции пациентов важно предупредить о том, что дыхание улучшится за счет некоторого ухудшения функции глотания. Открытым доступом возможно выполнение заднего расщепления перстневидного хряща с установкой реберного расширяющего трансплантата, который увеличивает просвет межчерпаловидного пространства. В случае, если после резекции рубца открытым доступом возможно восстановление подвижности черпаловидных хрящей, на задний отдел голосовой щели можно уложить щечный слизистый трансплантат или передвижной глоточный лоскут, которые позволяют предотвратить рестенозирование и восстановить просвет голосовой щели, но при этом не приводят к нарушению функций фонации и глотания.
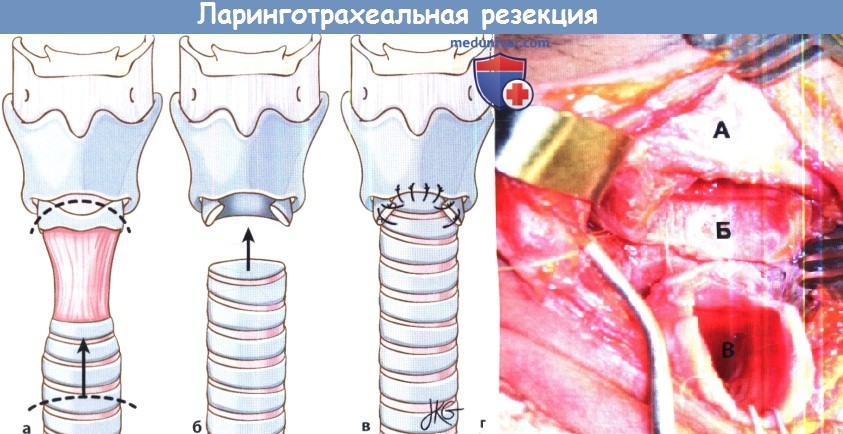
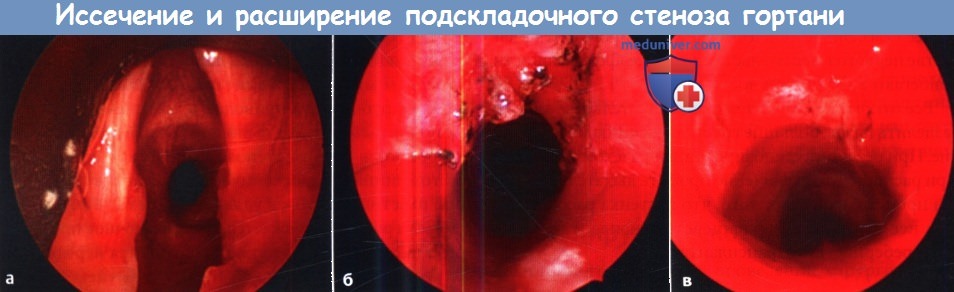
в) Операции для лечения подскладочного стеноза гортани: 1. Эндоскопические методы. Наиболее часто выполняется эндоскопическое радиальное рассечение рубца с последующей дилатацией. Рубец иссекается либо лазером, либо острым инструментарием. Дилатация может выполняться как пневматически, так и жестким инструментом. Теоретически, при выполнении радиального рассечения рубца можно сохранить промежутки здоровой слизистой оболочки, которые будут способствовать более быстрой реэпителизации в послеоперационном периоде и замедлят повторное формирование рубца. К дополнительным методам относят топическое применение митомицина С, который наносится на расширяемую область. Митомицин С представляет собой цитостатический антибактериальный препарат, который получают из бактерии Streptomyces caespitosus. Он способен подавлять пролиферацию фибробластов. Согласно данным одного исследования, применение митомицина С во время эндоскопического иссечения рубца статистически достоверно повышает вероятность успешности операции с 20% до 75%. К сожалению, другие исследования ставят эффективность митомицина С под вопрос. Также его применение связано с определенными осложнениями, например, образованием корок (которые могут приводить к обструкции дыхательных путей) и определенным риском малигнизации. К другим дополнительным методам лечения относятся топические и системные кортикостероиды, антибактериальная терапия в периоперационном периоде, анти-секреторные препараты. К сожалению, даже несмотря на вышеперечисленные меры, повторный стеноз развивается достаточно часто. 2. Переднее расщепление перстневидного хряща. Эта операция является формой расширения гортани и трахеи. Впервые она была описана как альтернатива трахеотомии у недоношенных детей с врожденным подскладочным стенозом. Передняя поверхность перстневидного хряща и два верхних кольца трахеи рассекаются, за счет чего перстневидный хрящ несколько раздвигается. В некоторых случаях пациент должен оставаться интубированным в течение 10 дней после операции, но вот выполнения трахеотомии лучше избегать. 3. Передняя и задняя ларинготрахеопластика. Передняя и задняя ларинготрахеопластика также являются операциями по расширению просвета гортани и трахеи. Чаще всего их применяют при подскладочных стенозах III и IV типов, а также при неэффективности эндоскопических методов лечения. Доступ осуществляется через ларингофиссуру. Переднее и/или заднее кольцо перстневидного хряща рассекаются вдоль средней линии, после чего устанавливаются хрящевые трансплантаты, которые поддерживают хрящевой остов гортани и трахеи в расширенном состоянии. Хрящевые трансплантаты забираются из ребра или из перегородки носа. Для проведения данной операции обычно требуется трахеотомия и установка внутрипросветных стентов, служащих для поддержки трансплантатов. 4. Крикотрахеальная резекция. В случае, если рубец локализуется в подскладочном пространстве, но при этом не затрагивает голосую щель (так, что небольшой «вход» в подскладочное пространство остается свободным), можно провести крикотрахеальную резекцию. В ходе этой операции удаляется рубцовая ткань с передней поверхности перстневидного хряща, а интактная трахея подшивается к задней поверхности перстневидного хряща, с которой была частично удалена слизистая оболочка. Некоторые хирурги предпочитают накладывать «шов Grillo», от подбородка до кожи грудины, который помогает пациентам не разгибать шею, не создавая, таким образом, ненужного натяжения в области анастамоза. При правильном подборе пациентов успешность операции превышает 90%. У большинства из этих пациентов в дальнейшем разовьются те или иные изменения голоса, которые могут быть постоянными.
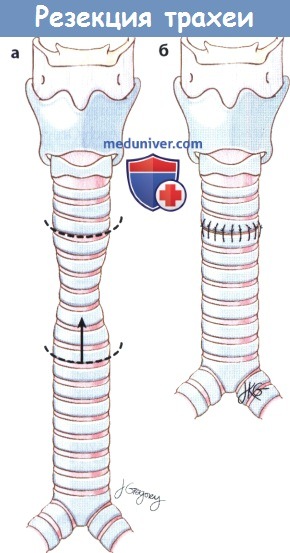
г) Операции для лечения стеноза трахеи: 1. Эндоскопические методики. Эндоскопические операции, применяющиеся при стенозе трахеи, в целом аналогичны таковым при подскладочном стенозе. Для рассечения или резекции рубца используется лазер или микроинструментарий, а дилатация выполняется либо пневматическим методом, либо жесткими инструментами. Дополнительно применяются митомицин С, кортикостероиды системно и местно, антибиотики и антисекреторные препараты. 2. Т-трубки и стенты. У пациентов с изолированным стенозом трахеи или подскладочного отдела гортани при сохраненной голосовой функции можно рассмотреть возможность применения стентов. Целесообразность использования стентов для лечения доброкачественного стеноза трахеи остается под вопросом. И хотя установка стента непосредственно увеличивает просвет дыхательных путей, существует ряд серьезных факторов, ограничивающих их применение: образование слизистых пробок, формирование грануляционной ткани, смещение стента, расхождение травмированных колец трахеи. Чаще стенты применяются в некоторых случаях злокачественной обструкции дыхательных путей и при неоперабельных опухолях, а также в редких случаях в качестве временной меры после хирургической резекции рубца. У тщательно отобранных пациентов, которым требуется восстановление проходимости дыхательных путей, но которые не желают использовать трахеотрубку, либо у тех пациентов, у которых использование трахеотрубки невозможно из-за того, что рубец расположен над стомой или в подскладочном пространстве, могут использоваться Т-трубки. Они расширяют просвет дыхательных путей и снизу, и сверху от стомы. Трубка устанавливается через имеющееся трахеотомическое отверстие, протяженность должна соответствовать протяженности рубца и/или деформированного фрагмента трахеи. Наружная часть Т-трубки предотвращает ее смещение, также через нее можно проводить санацию трахеи, вводить лекарственные препараты или физиологический раствор. Наружная трубка не используется для дыхания, для того, чтобы пациент мог дышать и говорить, ее нужно держать закрытой. Т-трубки лишены внутренней канюли, поэтому они могут забиваться слизью, особенно в тех случаях, когда для дыхания используется наружная трубка (т.к. воздух не согревается и не увлажняется верхними дыхательными путями). 3. Сегментарная резекция. Если область стеноза или деформированного фрагмента ограничена трахеей, простая резекция с анастамозом конец-в-конец позволяет добиться восстановления нормального дыхания в 90% случаев. Grillo и соавт. опубликовали сообщение о 503 пациентах с постинтубационным стенозом трахеи. У 471 пациента удалось добиться хороших (87,5%) или удовлетворительных (6,2%) результатов. Возможны следующие осложнения: формирование грануляционной ткани, появление дегисценций, травма гортанных нервов, обструкция дыхательных путей, медиастинит, кровотечение, инфицирование, инфаркт миокарда, трахеопищеводная фистула, пневмоторакс, тромбоз глубоких вен, рецидив стеноза и смерть.
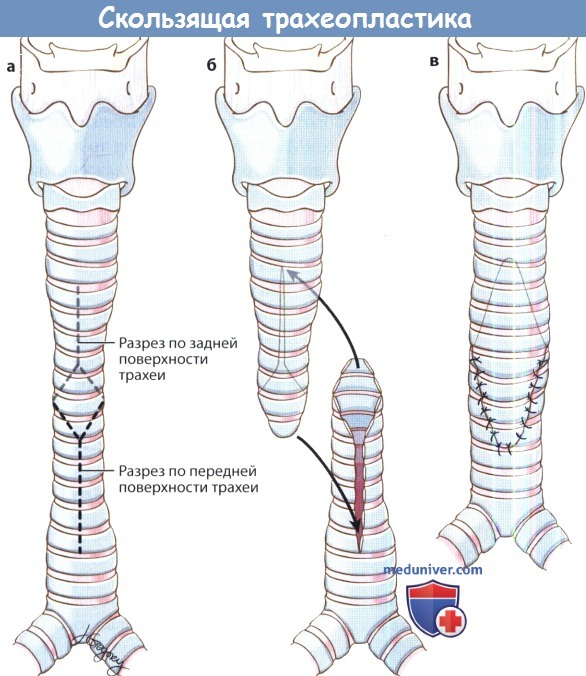
4. Аугментация. Для аугментационной трахеопластики могут использоваться аутотрансплантаты, например, реберный хрящ, надкостница, перикард, мышечные лоскуты на ножке, сложные трансплантаты, пищевод, брюшина или консервированная твердая мозговая оболочка. По нескольким причинам чаще всего применяют хрящ. Он представляет собой жесткую аутоткань, питание которой происходит методом диффузии, поэтому хрящ может приживаться даже в отсутствие непосредственного кровоснабжения. Ход операции в целом аналогичен расширяющей ларинготрахеопластике. 5. Скользящая трахеопластика. В случаях, если проведение сегментарной резекции невозможно из-за протяженности дефекта, может применяться скользящая трахеопластика. Эта операция чаще всего проводится при врожденных стенозах у детей, при травматических стенозах рутинно не используется. Подробный фотографический атлас операций на трехее представлен в отделном этом разделе сайта.
д) Заключение. В данной главе были кратно рассмотрены основные вопросы, касающиеся диагностики и лечения ларинготрахеального стеноза. Выбор метода лечения зависит от протяженности и локализации дефекта. К сожалению, лечение данного состояния остается крайне сложной проблемой, поэтому пациентов нужно информировать об ожиданиях и возможных рисках. Ключевые моменты: – Также рекомендуем “Частота и варианты травм гортани” |
Источник
В статье представлен алгоритм выбора тактики хирургического лечения больных со стенозами гортани
Проблема диагностики и лечения хронических паралитических и сочетанных стенозов гортани находится под пристальным вниманием оториноларингологов, хирургов, реаниматологов. В 75–95% случаев причинами стенозирования гортани и трахеи являются возросшая хирургическая активность на органах шеи с поражением ветвей блуждающего нерва, различного рода травмы гортани и нередко последствия хирургического лечения ее паралитических стенозов. Рубцово-паралитический стеноз гортани занимает 2-е место по частоте (29,9%) в структуре хронических заболеваний голосового аппарата [1–3].
Существующие методы диагностики и хирургического лечения больных многоэтапны, требуют значительных затрат на лечение, не всегда эффективны. Использование новых технологий и опорных материалов в реконструктивной хирургии позволяет реабилитировать большинство пациентов со стенозом гортани и трахеи травматической этиологии. Диагностика данной патологии стала возможной с появлением видеофиброларингоскопии, видеостробоскопии, магнитно-резонансной томографии (МРТ), спиральной компьютерной томографии. Тщательное дооперационное обследование позволяет выбрать оптимально эффективный способ первичного оперативного вмешательства, т. к. при его неудачном результате исчерпывается запас здоровой ткани, и паралитический стеноз гортани переходит в рубцово-паралитический [1, 5].
Реконструктивная хирургия гортани и трахеи на современном этапе развивается в 2-х основных направлениях: совершенствование хирургической техники и разработка мер профилактики послеоперационных осложнений; профилактика рестенозирования сформированного просвета в раннем и позднем послеоперационном периоде. Ларинготрахеопластика в сочетании с протезированием гортани и трахеи является наиболее перспективным методом, позволяющим восстанавливать анатомическую целостность органа и его функции [1, 3, 5, 8]. В настоящее время используются экстраларингеальные, эндоларингеальные (с наружным и эндоскопическим доступом) методы реконструктивной хирургии. Общепринятыми способами лечения травматических стенозов гортани являются эндоларингеальные хирургические вмешательства с наружным доступом с последующим разведением и фиксацией фрагментов гортани [9–11].
Рациональное стентирование на заключительном этапе операции необходимо для сохранения созданного просвета гортани. Формирование гортанно-трахеального просвета на Т-образной трубке является наиболее физиологичным, т. к. позволяет больным на время лечения сохранить гортанное и носовое дыхание. Нередко в раннем послеоперационном периоде нарушается защитная функция гортани из-за давления краниального конца трубки на основание надгортанника и черпало-надгортанные складки: слюна и пища попадают в дыхательные пути [8, 11, 12]. Важным является индивидуальный подбор эндопротеза с учетом строения шеи и конституции тела. Разработаны схемы ведения больных в послеоперационном периоде, включающие антибактериальную, антиоксидантную терапию, нестероидные противовоспалительные и улучшающие репарацию тканей препараты, физиотерапию и сеансы гипербарической оксигенации [1, 8].
C целью повышения эффективности хирургического лечения больных посттравматическими стенозами гортани разработан алгоритм выбора оперативной тактики, основанный на учете индивидуальных особенностей стереоморфометрических характеристик структур гортани у людей различного пола, с различным телосложением и строением шеи. Алгоритм включает: антропометрию пациента – определение варианта строения шеи и телосложения; построение регрессионных моделей значимых ларингометрических параметров; выбор оптимальной технологии ларингопластики в зависимости от клинических данных – размеров голосовой щели и положения голосовых складок; расчет размеров аутотрансплантата и длины Т-образной трубки, основанный на математическом анализе антропо- и органометрических характеристик пациента; ларинготрахеопластику и протезирование сформированного гортанно-трахеального просвета для предупреждения рецидива стеноза и рубцевания в отдаленном послеоперационном периоде.
Материал и методы
Под наблюдением с 2004 по 2015 г. находился 71 пациент в возрасте от 23 до 68 лет с хроническим посттравматическим стенозом гортани. Первичных больных было 65, остальные 6 были ранее оперированы: количество предыдущих операций составило от 1 до 5, а сроки лечения – от нескольких месяцев до 7 лет. Проводилось оториноларингологическое и общеклиническое обследование всех больных: тщательный сбор анамнеза, определение степени тяжести сопутствующей патологии. Использованы также антропометрия и объективные методы, характеризующие степень протяженности и характер патологического процесса (эндофибробронхоскопия, стробоскопия, спирометрия, рентгенотомография, компьютерная томография (КТ) гортани и трахеи).
Осуществлялся сравнительный анализ историй болезни пациентов с данной патологией, оперированных в клинике в периоды с 1996 по 2003 г. (n=24) и с 2004 по 2015 г. (n=71). У 24 больных (клиническая группа I – архивная) с паралитическими и сочетанными стенозами гортани изучались результаты хирургического лечения экстраларингеальным методом без учета конституции пациента и анализировались показатели деканюляции в отдаленном послеоперационном периоде (1 год). В клиническую группу II был включен 71 пациент с хроническим стенозом гортани, обследованный на дооперационном этапе с помощью антропометрии, спирометрии, КТ и фиброларингоскопии, оперированный по усовершенствованным методикам с учетом варианта строения шеи и телосложения. Первым этапом выполнялась трахеостомия, вторым – отсроченная (через 1–1,5 мес.) ларинготрахеопластика. Оценка эффективности лечения больных II группы (n=71) проводилась по критериям: деканюляция, динамика показателей функции внешнего дыхания (ФВД) и интенсивность голоса до и после ларингопластики (в отдаленном послеоперационном периоде).
Пациенты клинической группы II (n=71) оперированы с использованием следующих усовершенствованных методик с учетом варианта строения шеи и телосложения:
– экстраларингеальная ЛФ ГС (n=22);
– ЛФ ГС со стентированием Т-образной силиконовой трубкой (n=43);
– рассечение рубцов после предыдущих ларингопластик с последующим стентированием гортани (n=6).
Согласно разработанной и примененной в клинике методике конституциональной ларингостереотопометрии [патент № 48738 РФ] у больных дооперационно по антропометрическим данным и регрессионным моделям (p<0,05) определялись необходимые при проведении ларингопластики параметры гортани, а также размеры Т-образного эндопротеза и хрящевого аутотрансплантата под переднюю треть голосовой складки [4, 6, 7].
22 пациентам (31%) с хроническим паралитическим стенозом производилась ЛФ ГС с аритеноидотомией [патент № 2284773 РФ], включающая экстраларингеальный подход к пластине щитовидного хряща спереди, поднадхрящничную резекцию голосового отростка черпаловидного хряща с иссечением внутренней перстнещитовидной и большей части щиточерпаловидной мышц; укладывание аутохряща под переднюю треть голосовой складки; отведение эластического конуса с голосовой складкой путем наложения лигатур и затягивание их на аутотрансплантате, наложенном на пластину щитовидного хряща. Резекция голосового отростка черпаловидного хряща с иссечением щиточерпаловидной и внутренней перстнещитовидной мышц приводит к расширению межскладкового пространства и улучшению дыхательной функции, а подведение предварительно смоделированного по регрессионным моделям аутохряща перегородки носа под переднюю треть голосовой складки способствует сохранению голосовой функции [4, 6].
Пациентам с имеющимся рубцовым процессом в голосовом отделе (60,6%) от предыдущих вмешательств (n=43) после выполнения экстраларингеальной ЛФ ГС (рубцово-неизмененной) с аритеноидотомией выполнялось стентирование гортани и трахеи силиконовой Т-образной трубкой с предварительной коррекцией ее краниального и каудального отрезков [7]. У 6 пациентов с подголосовым стенозом (8,45%) после многократных вмешательств на голосовых складках рубцовая ткань после рассечения распределялась по периметру гортани и трахеи для уменьшения сроков эпителизации сформированного просвета на Т-образном эндопротезе. Во избежание рестенозирования в подскладковом пространстве проводились редрессация перстневидного хряща и формирование боковых стенок трахеи с помощью кожно-васкуляризированных лоскутов.
Таким образом, у 49 пациентов (69%) после ларингопластики проводилось стентирование сформированного ларинготрахеального просвета силиконовой Т-образной трубкой, предварительно смоделированной с учетом антропометрических данных и регрессионных моделей [патент № 2432969 РФ]. Существует 2 вида наиболее применяемых Т-образных силиконовых трубок у взрослых (ЗАО «Медсил»): «ТЭТсО-13/23-45/70/40» (длина краниального отрезка – 45 мм, каудального отрезка – 70 мм, диаметр овального отводящего конца – 13/23, длина – 40 мм) и «ТЭТсК-15/15-50/80/60» (длина краниального отрезка – 50 мм, каудального отрезка – 80 мм, диаметр круглого отводящего конца – 15/15, длина – 60 мм). Заводская длина краниального отрезка 45–50 мм практически всегда превышает необходимую после ларингопластики, особенно у пациентов с толстой и короткой шеей. Разработанная и примененная в клинике методика коррекции длины Т-образной трубки основана на математическом анализе органо- и антропометрических характеристик пациента: длины и окружности шеи, длины тела, акромиального диаметра, окружности грудной клетки. Составлены регрессионные уравнения для расчета длин отрезков Т-образной трубки по антропометрическим данным для мужчин и женщин (p<0,05) [7]. Смоделированная трубка «ТЭТсО–13/23-45/70/40» вводилась на созданное анатомо-функциональное ложе после ларингопластики. У 4-х пациентов (5,8%) наблюдалось нарушение защитной функции гортани в раннем послеоперационном периоде, которое разрешилось после коррекции длины краниального отрезка эндопротеза под контролем фиброларингоскопии. При смене эндопротеза в раннем послеоперационном периоде во избежание травм слизистой гортани и кожно-трахеальных швов проводились тракции на себя и книзу, при этом краниальный конец стента придерживался изогнутым зажимом в просвете трахеи до момента его складывания, после чего трубка извлекалась. Перед введением трубки ее наружную поверхность покрывали слоем лечебной мази. Сначала устанавливался каудальный отрезок для предотвращения гипоксии, затем – краниальный. Расположение последнего выше голосовых складок и зоны реконструкции контролировалось методом непрямой ларингоскопии и фиброларингоскопии, после чего наружное колено трубки закрывалось герметично притертой пробкой, при этом дыхание через естественные пути не должно быть затрудненным.
Этиотропная и патогенетическая терапия в послеоперационном периоде проводилась с учетом микробного пейзажа раневого отделяемого и чувствительности выделенных микроорганизмов к антибиотикам. Использовались препараты местного действия: мази с антибактериальным и противовоспалительным действием (в состав которых входят хлорамфеникол и мупироцин), а также содержащие гепариноиды и ангиопротекторы. В течение первых 5 сут после операции проводилась регулярная санация трахеобронхиального дерева с помощью эндофибробронхоскопии и катетеризации через Т-образный стент. Ингаляции муколитиков, антибиотиков и стероидных препаратов проводились 2 р./сут через естественные дыхательные пути с закрытым Т-образным стентом и трахеостому в первые 3–5 сут. Все пациенты были выписаны на 17–21-е сут после операции, обучившись самостоятельной смене и туалету Т-образной трубки. Динамическое наблюдение за больными после выписки из стационара должно проводиться каждые 10 дней. При контрольном осмотре методом фиброларинготрахеоскопии оценивались адекватность протезирования, размер гортанно-трахеального просвета и состояние слизистой оболочки гортани и трахеи на уровне верхнего и нижнего сегментов Т-образной трубки. Рецидивов стеноза не последовало, что подтверждено исследованиями ФВД в ближайшем и отдаленном (1 год) послеоперационном периоде. На заключительном этапе реабилитации через 6–8 мес. проводилось ушивание ларинготрахеального дефекта по Бокштейну после контрольного периода наблюдения в стационаре с герметично заклеенной ларинготрахеостомой.
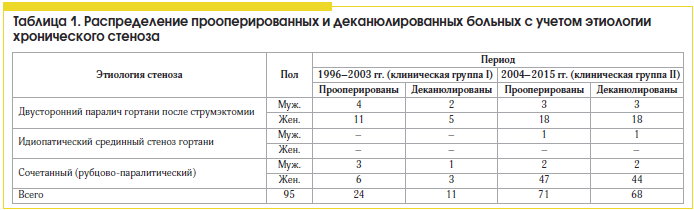
Проанализированы результаты хирургического лечения больных с хроническими стенозами гортани (n=71), у которых в предоперационном планировании ларингопластику и подбор оптимальных размеров эндопротеза и аутотрансплантата осуществляли с учетом регрессионных моделей (2004–2015 гг.). Они были сопоставлены с результатами хирургического лечения больных (n=24), проведенного традиционным методом без использования регрессионных моделей и антропометрических данных пациента (1996–2003 гг.). Учитывали наличие технических интра- и послеоперационных осложнений; неадекватные размеры эндопротеза и трансплантата; наличие грануляций и хондроперихондрита хрящевых структур; прорезывание латерофиксирующего шва и дислокацию голосовой складки к средней линии; нарушение защитной функции гортани в послеоперационном периоде (табл. 1). В клинической группе I (архивной) из 24 пациентов, оперированных экстраларингеальным доступом без учета шейного индекса и конституции, было деканюлировано 11 больных (45,8%). У 6 пациентов в раннем послеоперационном периоде латерофиксирующие швы прорезались в связи с присоединившимся отеком и гематомой подскладкового пространства; у 5 больных наблюдался хондроперихондрит гортани.
В клинической группе II (n=71) оценка динамики показателей ФВД и интенсивности голоса до и после ларингопластики (1 год) проводилась раздельно у пациентов с паралитическими (n=22) и сочетанными (n=49) стенозами гортани.
После хирургического лечения у 22 (31%) пациентов с паралитическим стенозом гортани методом экстраларингеальной ЛФ ГС с аритеноидотомией основные показатели ФВД приблизились к условной норме, а индекс Тиффно – к норме, что клинически соответствует компенсации стеноза гортани. Подведение под переднюю треть голосовой складки смоделированного по регрессионным моделям аутотрансплантата позволило сохранить и незначительно улучшить интенсивность голоса – с 57,4±0,2 до 59,7±0,2 дБ.
Хирургическое лечение и дилатация сформированного просвета Т-образной силиконовой трубкой проводились у 49 (69%) пациентов клинической группы II. В данной подгруппе больных с хроническим сочетанным стенозом гортани применен способ подбора длины Т-образной трубки [7], основанный на математическом анализе антропо- и органометрических характеристик пациента. Через 8 мес. основные показатели ФВД приблизились к нормальным значениям и выросли на 14,5–29,3%, а индекс Тиффно – на 33,6%.
Сравнительный анализ эффективности хирургического лечения 95 больных с посттравматическими стенозами гортани за периоды с 1996 по 2003 г. (n=24, клиническая группа I) и с 2004 по 2015 г. (n=71, клиническая группа II), когда дооперационно стало проводиться прогнозирование ларингометрических параметров по шейному индексу пациента и антропометрическим данным, показал, что количество деканюлированных пациентов увеличилось с 45,8 до 95,8% (см. табл. 1). Из 71 пациента с посттравматическими стенозами гортани дыхательная функция была восстановлена у 68 (95,8%).
С учетом разработанной и примененной методики конституциональной ларингостереотопометрии разработан алгоритм выбора тактики хирургического лечения больных с параличами и сочетанными стенозами гортани. По антропометрическим данным для каждого пациента клинической группы II (n=71) дооперационно были построены регрессионные модели необходимых ларингометрических параметров, выбрана оптимальная технология ларингопластики в зависимости от клинических данных – размеров голосовой щели и положения голосовых складок (рис. 1).

В результате использования предложенного алгоритма выбора тактики оперативного лечения полная реа